59/2015. (XII. 30.) EMMI rendelet
egyes egészségbiztosítási tárgyú miniszteri rendeletek módosításáról1
2016.01.01.
a) 2. §-ában a „jegyzékét” szövegrész helyébe a „jegyzékét, kódját, valamint az elszámolásra jogosult intézetek körét” szöveg,
„(3) Az oszteoporózis következtében kialakuló csonttörés primer prevenciójának finanszírozási eljárásrendjét a 15. melléklet tartalmazza. (4) Az oszteoporózis következtében kialakuló csonttörés szekunder prevenciójának finanszírozási eljárásrendjét a 16. melléklet tartalmazza.”
4. § Az R2. 5. §-a helyébe a következő rendelkezés lép:
„5. § (1) A myeloma multiplex kezelésének finanszírozási eljárásrendjét a 19. melléklet tartalmazza. (2) A stroke elsődleges megelőzésének finanszírozási eljárásrendjét a 20. melléklet tartalmazza. (3) Az újabb stroke megelőzésének finanszírozási eljárásrendjét a 21. melléklet tartalmazza. (4) Az ischaemias stroke-ot elszenvedett, thrombolysisre alkalmas betegek ellátásának finanszírozási eljárásrendjét a 22. melléklet tartalmazza. (5) A gyomordaganatok diagnosztikájának és kezelésének finanszírozási eljárásrendjét a 23. melléklet tartalmazza. (6) Az ST elevációval nem járó myocardialis infarktus és az instabil angina diagnosztikájának és terápiájának finanszírozási eljárásrendjét a 24. melléklet tartalmazza. (7) A stabil angina pectoris diagnosztikájának és terápiájának finanszírozási eljárásrendjét a 25. melléklet tartalmazza. (8) A nem-seminoma típusú heredaganatok kezelésének finanszírozási eljárásrendjét a 26. melléklet tartalmazza. (9) A seminoma típusú heredaganatok kezelésének finanszírozási eljárásrendjét a 27. melléklet tartalmazza. (10) A húgyhólyagrák diagnosztikájának és kezelésének finanszírozási eljárásrendjét a 28. melléklet tartalmazza. (11) A prosztata daganatok diagnosztikájának és kezelésének finanszírozási eljárásrendjét a 29. melléklet tartalmazza. (12) A szkizofrénia antipszichotikus gyógyszeres kezelésének finanszírozási eljárásrendjét a 30. melléklet tartalmazza. (13) A sclerosis multiplex diagnosztikájának és kezelésének finanszírozási eljárásrendjét a 31. melléklet tartalmazza. (14) A sigma és colon daganatok diagnosztikájának és kezelésének finanszírozási eljárásrendjét a 32. melléklet tartalmazza. (15) A rectum daganatok diagnosztikájának és kezelésének finanszírozási eljárásrendjét a 33. melléklet tartalmazza. (16) A szénhidrát-anyagcsere rendezése 2-es típusú cukorbetegségben nem terhes felnőttekben finanszírozási eljárásrendjét a 34. melléklet tartalmazza. (17) A gyermekkori asthma bronchiale diagnosztikájának és gyógyszeres kezelésének finanszírozási eljárásrendjét a 35. melléklet tartalmazza. (18) A krónikus obstruktív tüdőbetegség (COPD) diagnosztikájának és gyógyszeres kezelésének finanszírozási eljárásrendjét a 36. melléklet tartalmazza. (19) Az asthma bronchiale diagnosztikája és gyógyszeres kezelése felnőttkorban finanszírozási eljárásrendjét a 37. melléklet tartalmazza. (20) Korai és helyileg kiterjedt (nem távoli áttétes) nem-kissejtes tüdőrák (NSCLC) diagnosztikájának és kezelésének finanszírozási eljárásrendjét a 38. melléklet tartalmazza. (21) Az ST-elevációval járó akut myocardiális infarktus diagnosztikájának és terápiájának finanszírozási eljárásrendjét a 39. melléklet tartalmazza. (22) Lokálisan kiterjedt inoperábilis és áttétes nem-kissejtes tüdőrák (NSCLC) diagnosztikájának és kezelésének finanszírozási eljárásrendjét a 40. melléklet tartalmazza. (23) A kissejtes tüdődaganatok diagnosztikájának és kezelésének finanszírozási eljárásrendjét a 41. melléklet tartalmazza.”
3. Az Egészségbiztosítási Alap terhére finanszírozható járóbeteg-szakellátási tevékenységek meghatározásáról, az igénybevétel során alkalmazandó elszámolhatósági feltételekről és szabályokról, valamint a teljesítmények elszámolásáról szóló 9/2012. (II. 28.) NEFMI rendelet módosítása
4. A gyógyító-megelőző ellátás jogcímén az Egészségbiztosítási Alap terhére finanszírozható homogén betegségcsoportok kódolási és besorolási szabályairól szóló 10/2012. (II. 28.) NEFMI rendelet módosítása
5. Az Egészségbiztosítási Alapból a 959A-L, valamint 9511–9515 homogén betegségcsoportok szerint finanszírozott daganatellenes terápiákról szóló 11/2012. (II. 28.) NEFMI rendelet módosítása
9. § Ez a rendelet a kihirdetését követő hónap első napján lép hatályba.
1. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
Tételes elszámolás alá eső egyszerhasználatos eszközök és implantátumok jegyzéke, kódja, valamint az elszámolásra jogosult intézetek köre
1. 01000 Gerinc belső fixációs implantátum
Elszámolásra jogosult intézetek:
0301 Bács-Kiskun Megyei Kórház
0401 Békés Megyei Pándy Kálmán Kórház
0502 Borsod-Abaúj-Zemplén Megyei Kórház és Egyetemi Oktató Kórház
0701 Fejér Megyei Szent György Egyetemi Oktató Kórház
0801 Petz Aladár Megyei Oktató Kórház, Győr
1101 Szent Borbála Kórház, Tatabánya
1401 Somogy Megyei Kaposi Mór Oktató Kórház
1601 Jász-Nagykun-Szolnok Megyei Hetényi Géza Kórház Rendelőintézet
0109 Egyesített Szent István és Szent László Kórház-Rendelőintézet
0106 Szent János Kórház és Észak-Budai Egyesített Kórházak
0116 Péterfy Sándor utcai Kórház-Rendelőintézet és Baleseti Központ
0940 Debreceni Egyetem Klinikai Központ
0163 Országos Klinikai Idegtudományi Intézet
0242 Pécsi Tudományegyetem Klinikai Központ
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
01A3 Budai Egészségközpont Kft.
01A6 Magyar Honvédség Egészségügyi Központ, Budapest
1801 Markusovszky Egyetemi Oktatókórház
1501 Szabolcs-Szatmár-Bereg megyei Kórházak és Egyetemi Oktatókórház
0901 Kenézy Gyula Kórház és Rendelőintézet
2. 01001 HALO készülék
Elszámolásra jogosult intézetek:
0301 Bács-Kiskun Megyei Kórház
0401 Békés Megyei Pándy Kálmán Kórház
0402 Dr. Réthy Pál Kórház-Rendelőintézet
0502 Borsod-Abaúj-Zemplén Megyei Kórház és Egyetemi Oktató Kórház
0701 Fejér Megyei Szent György Egyetemi Oktató Kórház
0801 Petz Aladár Megyei Oktató Kórház, Győr
1101 Szent Borbála Kórház, Tatabánya
1401 Somogy Megyei Kaposi Mór Oktató Kórház
1601 Jász-Nagykun-Szolnok Megyei Hetényi Géza Kórház Rendelőintézet
1701 Tolna Megyei Balassa János Kórház
2001 Zala Megyei Kórház
2002 Kanizsai Dorottya Kórház
0109 Egyesített Szent István és Szent László Kórház-Rendelőintézet
0106 Szent János Kórház és Észak-Budai Egyesített Kórházak
0116 Péterfy Sándor utcai Kórház-Rendelőintézet és Baleseti Központ
0940 Debreceni Egyetem Klinikai Központ
0163 Országos Klinikai Idegtudományi Intézet
0242 Pécsi Tudományegyetem Klinikai Központ
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
01A6 Magyar Honvédség Egészségügyi Központ, Budapest
1801 Markusovszky Egyetemi Oktatókórház
1501 Szabolcs-Szatmár-Bereg megyei Kórházak és Egyetemi Oktatókórház
0901 Kenézy Gyula Kórház és Rendelőintézet
3. 01010 Scoliosis implantátum
Elszámolásra jogosult intézetek:
0940 Debreceni Egyetem Klinikai Központ
0242 Pécsi Tudományegyetem Klinikai Központ
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
01A3 Budai Egészségközpont Kft.
4. 01050 Közép- és belsőfül hallásjavító implantátum és processzor
Elszámolásra jogosult intézetek:
0122 Heim Pál Gyermekkórház
0940 Debreceni Egyetem Klinikai Központ
0242 Pécsi Tudományegyetem Klinikai Központ
0140 Semmelweis Egyetem
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
5. 01062 Érprotézisek gyűrűs vagy külső spirál erősítéssel (egyenes protézis, Y protézis)
Elszámolásra jogosult intézetek:
0301 Bács-Kiskun Megyei Kórház
0401 Békés Megyei Pándy Kálmán Kórház
0502 Borsod-Abaúj-Zemplén Megyei Kórház és Egyetemi Oktató Kórház
0701 Fejér Megyei Szent György Egyetemi Oktató Kórház
0801 Petz Aladár Megyei Oktató Kórház, Győr
1101 Szent Borbála Kórház, Tatabánya
1201 Szent Lázár Megyei Kórház
1309 Pest Megyei Flór Ferenc Kórház
1401 Somogy Megyei Kaposi Mór Oktató Kórház
1601 Jász-Nagykun-Szolnok Megyei Hetényi Géza Kórház Rendelőintézet
1701 Tolna Megyei Balassa János Kórház
2001 Zala Megyei Kórház
0112 Bajcsy-Zsilinszky Kórház és Rendelőintézet
0109 Egyesített Szent István és Szent László Kórház-Rendelőintézet
0115 Jahn Ferenc Dél-Pesti Kórház és Rendelőintézet
0106 Szent János Kórház és Észak-Budai Egyesített Kórházak
0116 Péterfy Sándor utcai Kórház-Rendelőintézet és Baleseti Központ
0101 Szent Imre Kórház
0118 Uzsoki utcai Kórház
0940 Debreceni Egyetem Klinikai Központ
0242 Pécsi Tudományegyetem Klinikai Központ
0140 Semmelweis Egyetem
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
01A6 Magyar Honvédség Egészségügyi Központ, Budapest
0702 Szent Pantaleon Kórház - Rendelőintézet Dunaújváros
10E8 Szent Margit Kórház
1011 Markhot Ferenc Oktatókórház és Rendelőintézet
13B2 Toldy Ferenc Kórház és Rendelőintézet
1901 Csolnoky Ferenc Kórház
1801 Markusovszky Egyetemi Oktatókórház
1501 Szabolcs-Szatmár-Bereg megyei Kórházak és Egyetemi Oktatókórház
6. 01063 Érprotézis dialízis shunt készítéséhez
Elszámolásra jogosult intézetek:
0502 Borsod-Abaúj-Zemplén Megyei Kórház és Egyetemi Oktató Kórház
0801 Petz Aladár Megyei Oktató Kórház, Győr
2001 Zala Megyei Kórház
0140 Semmelweis Egyetem
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
01A6 Magyar Honvédség Egészségügyi Központ, Budapest
1801 Markusovszky Egyetemi Oktatókórház
7. Keringéstámogató eszközök
7/a. 01080 Felnőtt szívműtétekhez használt szívstabilizátor és tartozékai vagy oxigenátor csőkészlettel
Elszámolásra jogosult intézetek:
2001 Zala Megyei Kórház
0940 Debreceni Egyetem Klinikai Központ
0162 Gottsegen György Országos Kardiológiai Intézet
0242 Pécsi Tudományegyetem Klinikai Központ
0140 Semmelweis Egyetem
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
01A6 Magyar Honvédség Egészségügyi Központ, Budapest
7/b. 01081 Gyermek szívműtétekhez használt szívstabilizátor és tartozékai vagy oxigenátor csőkészlettel
Elszámolásra jogosult intézetek:
0162 Gottsegen György Országos Kardiológiai Intézet
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
7/c. 01504 Rövidtávú keringéstámogató eszközök és tartozékai (IABP)
Elszámolásra jogosult intézetek:
0301 Bács-Kiskun Megyei Kórház
0502 Borsod-Abaúj-Zemplén Megyei Kórház és Egyetemi Oktató Kórház
0701 Fejér Megyei Szent György Egyetemi Oktató Kórház
0801 Petz Aladár Megyei Oktató Kórház, Győr
1401 Somogy Megyei Kaposi Mór Oktató Kórház
1601 Jász-Nagykun-Szolnok Megyei Hetényi Géza Kórház Rendelőintézet
2001 Zala Megyei Kórház
0112 Bajcsy-Zsilinszky Kórház és Rendelőintézet
1968 Balatonfüredi Állami Szívkórház
0940 Debreceni Egyetem Klinikai Központ
0162 Gottsegen György Országos Kardiológiai Intézet
0242 Pécsi Tudományegyetem Klinikai Központ
0140 Semmelweis Egyetem, Budapest
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
01A6 Magyar Honvédség Egészségügyi Központ, Budapest
2237 Budai Irgalmasrendi Kórház
1801 Markusovszky Egyetemi Oktatókórház
1501 Szabolcs-Szatmár-Bereg megyei Kórházak és Egyetemi Oktatókórház
7/d. 01521 Hosszútávú keringéstámogató eszközök és tartozékai (műszív)
Elszámolásra jogosult intézetek:
0140 Semmelweis Egyetem
0162 Gottsegen György Országos Kardiológiai Intézet
7/e. 01523 Középtávú keringéstámogató eszközök és tartozékai (ECMO)
Elszámolásra jogosult intézetek:
0140 Semmelweis Egyetem
0162 Gottsegen György Országos Kardiológiai Intézet
8. 01090 Pacemakerek, implantálható kardioverter-defibrillátorok és elektrodáik
Elszámolásra jogosult intézetek:
0502 Borsod-Abaúj-Zemplén Megyei Kórház és Egyetemi Oktató Kórház
1601 Jász-Nagykun-Szolnok Megyei Hetényi Géza Kórház Rendelőintézet
2001 Zala Megyei Kórház
1968 Balatonfüredi Állami Szívkórház
0940 Debreceni Egyetem Klinikai Központ
0162 Gottsegen György Országos Kardiológiai Intézet
0242 Pécsi Tudományegyetem Klinikai Központ
0140 Semmelweis Egyetem
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
01A6 Magyar Honvédség Egészségügyi Központ, Budapest
2237 Budai Irgalmasrendi Kórház
13B2 Toldy Ferenc Kórház és Rendelőintézet
1501 Szabolcs-Szatmár-Bereg megyei Kórházak és Egyetemi Oktatókórház
0701 Fejér Megyei Szent György Egyetemi Oktató Kórház
0801 Petz Aladár Megyei Oktató Kórház, Győr
0802 Soproni Erzsébet Oktató Kórház és Rehabilitációs Intézet
1101 Szent Borbála Kórház, Tatabánya
1801 Markusovszky Egyetemi Oktatókórház
9. 01110 Szívbillentyűk (mű, biológiai)
Elszámolásra jogosult intézetek:
2001 Zala Megyei Kórház
0940 Debreceni Egyetem Klinikai Központ
0162 Gottsegen György Országos Kardiológiai Intézet
0242 Pécsi Tudományegyetem Klinikai Központ
0140 Semmelweis Egyetem
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
01A6 Magyar Honvédség Egészségügyi Központ, Budapest
10. Kardiológiai ablációs és elektroanatómiai térképező katéterek
10/a. 01123 Kardiológiai ablációs katéterek
Elszámolásra jogosult intézetek:
1601 Jász-Nagykun-Szolnok Megyei Hetényi Géza Kórház Rendelőintézet
2001 Zala Megyei Kórház
1968 Balatonfüredi Állami Szívkórház
0940 Debreceni Egyetem Klinikai Központ
0162 Gottsegen György Országos Kardiológiai Intézet
0242 Pécsi Tudományegyetem Klinikai Központ
0140 Semmelweis Egyetem
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
01A6 Magyar Honvédség Egészségügyi Központ, Budapest
2237 Budai Irgalmasrendi Kórház
13B2 Toldy Ferenc Kórház és Rendelőintézet
10/b. 01124 Kardiológiai elektroanatómiai térképező katéter
Elszámolásra jogosult intézetek:
1601 Jász-Nagykun-Szolnok Megyei Hetényi Géza Kórház Rendelőintézet
2001 Zala Megyei Kórház
1968 Balatonfüredi Állami Szívkórház
0940 Debreceni Egyetem Klinikai Központ
0162 Gottsegen György Országos Kardiológiai Intézet
0242 Pécsi Tudományegyetem Klinikai Központ
0140 Semmelweis Egyetem
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
01A6 Magyar Honvédség Egészségügyi Központ, Budapest
2237 Budai Irgalmasrendi Kórház
13B2 Toldy Ferenc Kórház és Rendelőintézet
11. 01130 Ventriculo-atrialis shunt, ventriculo-peritonealis shunt, lumbo-peritonealis shunt
Elszámolásra jogosult intézetek:
0301 Bács-Kiskun Megyei Kórház
0401 Békés Megyei Pándy Kálmán Kórház
0502 Borsod-Abaúj-Zemplén Megyei Kórház és Egyetemi Oktató Kórház
0701 Fejér Megyei Szent György Egyetemi Oktató Kórház
0801 Petz Aladár Megyei Oktató Kórház, Győr
1101 Szent Borbála Kórház, Tatabánya
1401 Somogy Megyei Kaposi Mór Oktató Kórház
1601 Jász-Nagykun-Szolnok Megyei Hetényi Géza Kórház Rendelőintézet
0122 Heim Pál Gyermekkórház
0109 Egyesített Szent István és Szent László Kórház-Rendelőintézet
0106 Szent János Kórház és Észak-Budai Egyesített Kórházak
0116 Péterfy Sándor utcai Kórház-Rendelőintézet és Baleseti Központ
0940 Debreceni Egyetem Klinikai Központ
0163 Országos Klinikai Idegtudományi Intézet
0242 Pécsi Tudományegyetem Klinikai Központ
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
01A6 Magyar Honvédség Egészségügyi Központ, Budapest
1801 Markusovszky Egyetemi Oktatókórház
1501 Szabolcs-Szatmár-Bereg megyei Kórházak és Egyetemi Oktatókórház
12. 01140 Peritoneo-venosus shunt
Elszámolásra jogosult intézetek:
0801 Petz Aladár Megyei Oktató Kórház, Győr
0122 Heim Pál Gyermekkórház
0242 Pécsi Tudományegyetem Klinikai Központ
0140 Semmelweis Egyetem
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
1801 Markusovszky Egyetemi Oktatókórház
0901 Kenézy Gyula Kórház és Rendelőintézet
13. 01150 Transjuguláris, intrahepatikus porto-cavalis shunt (TIPS)
Elszámolásra jogosult intézetek:
0502 Borsod-Abaúj-Zemplén Megyei Kórház és Egyetemi Oktató Kórház
0940 Debreceni Egyetem Klinikai Központ
0242 Pécsi Tudományegyetem Klinikai Központ
0140 Semmelweis Egyetem
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
1801 Markusovszky Egyetemi Oktatókórház
1501 Szabolcs-Szatmár-Bereg megyei Kórházak és Egyetemi Oktatókórház
14. 0117A Sűrűfonatú öntáguló intracranialis stent
Elszámolásra jogosult intézetek:
0940 Debreceni Egyetem Klinikai Központ
0163 Országos Klinikai Idegtudományi Intézet
0242 Pécsi Tudományegyetem Klinikai Központ
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
15. 01204 Orbitális implantátum
Elszámolásra jogosult intézetek:
0940 Debreceni Egyetem Klinikai Központ
0140 Semmelweis Egyetem
16. 01310 Felszínpótló csípőízületi protézis
Elszámolásra jogosult intézetek:
0140 Semmelweis Egyetem
0242 Pécsi Tudományegyetem Klinikai Központ
0940 Debreceni Egyetem Klinikai Központ
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
17. 01323 Felszínpótló bokaízületi protézis
Elszámolásra jogosult intézetek:
0140 Semmelweis Egyetem
0242 Pécsi Tudományegyetem Klinikai Központ
0940 Debreceni Egyetem Klinikai Központ
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
18. Maxillo-faciális belső fixációs eszközök és helyreállító protesisek, ideértve a CAD-CAM eljárással tervezett koponya- és arccsontpótlást is
18/a. 01338 Maxillo-faciális belső fixációs eszközök
Elszámolásra jogosult intézetek:
0301 Bács-Kiskun Megyei Kórház
0401 Békés Megyei Pándy Kálmán Kórház
0402 Dr. Réthy Pál Kórház Rendelőintézet
0502 Borsod-Abaúj-Zemplén Megyei Kórház és Egyetemi Oktató Kórház
0701 Fejér Megyei Szent György Egyetemi Oktató Kórház
0801 Petz Aladár Megyei Oktató Kórház, Győr
1401 Somogy Megyei Kaposi Mór Oktató Kórház
2001 Zala Megyei Kórház
0106 Szent János Kórház és Észak-Budai Egyesített Kórházak
0116 Péterfy Sándor utcai Kórház-Rendelőintézet és Baleseti Központ
0940 Debreceni Egyetem Klinikai Központ
0242 Pécsi Tudományegyetem Klinikai Központ
0140 Semmelweis Egyetem
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
01A6 Magyar Honvédség Egészségügyi Központ, Budapest
1901 Csolnoky Ferenc Kórház
1801 Markusovszky Egyetemi Oktatókórház
0901 Kenézy Gyula Kórház és Rendelőintézet
18/b. 01340 CAD-CAM eljárással tervezett koponya- és arccsontpótló eszközök
Elszámolásra jogosult intézetek:
0116 Péterfy Sándor utcai Kórház-Rendelőintézet és Baleseti Központ
0163 Országos Klinikai Idegtudományi Intézet
0140 Semmelweis Egyetem
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
01A6 Magyar Honvédség Egészségügyi Központ, Budapest
18/c. 01343 Maxillo-faciális helyreállító protézisek
Elszámolásra jogosult intézetek:
0301 Bács-Kiskun Megyei Kórház
0940 Debreceni Egyetem Klinikai Központ
0242 Pécsi Tudományegyetem Klinikai Központ
0140 Semmelweis Egyetem
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
19. 01339 Gyógyszerkibocsátó coronaria stent
Elszámolásra jogosult intézetek:
0301 Bács-Kiskun Megyei Kórház
0401 Békés Megyei Pándy Kálmán Kórház
0502 Borsod-Abaúj-Zemplén Megyei Kórház és Egyetemi Oktató Kórház
0701 Fejér Megyei Szent György Egyetemi Oktató Kórház
0801 Petz Aladár Megyei Oktató Kórház, Győr
1401 Somogy Megyei Kaposi Mór Oktató Kórház
1601 Jász-Nagykun-Szolnok Megyei Hetényi Géza Kórház Rendelőintézet
2001 Zala Megyei Kórház
0112 Bajcsy-Zsilinszky Kórház és Rendelőintézet
1968 Balatonfüredi Állami Szívkórház
0940 Debreceni Egyetem Klinikai Központ
0162 Gottsegen György Országos Kardiológiai Intézet
0242 Pécsi Tudományegyetem Klinikai Központ
0140 Semmelweis Egyetem
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
01A6 Magyar Honvédség Egészségügyi Központ, Budapest
2237 Budai Irgalmasrendi Kórház
1801 Markusovszky Egyetemi Oktatókórház
1501 Szabolcs-Szatmár-Bereg megyei Kórházak és Egyetemi Oktatókórház
20. 01346 Implantálható tartós ér- és epiduralis katéter
Elszámolásra jogosult intézetek:
0301 Bács-Kiskun Megyei Kórház
0401 Békés Megyei Pándy Kálmán Kórház
0502 Borsod-Abaúj-Zemplén Megyei Kórház és Egyetemi Oktató Kórház
0801 Petz Aladár Megyei Oktató Kórház, Győr
1401 Somogy Megyei Kaposi Mór Oktató Kórház
1601 Jász-Nagykun-Szolnok Megyei Hetényi Géza Kórház Rendelőintézet
2001 Zala Megyei Kórház
0123 Magyarországi Református Egyház Bethesda Gyermekkórháza
0122 Heim Pál Gyermekkórház
0109 Egyesített Szent István és Szent László Kórház-Rendelőintézet
0940 Debreceni Egyetem Klinikai Központ
0154 Országos Onkológiai Intézet
0242 Pécsi Tudományegyetem Klinikai Központ
0140 Semmelweis Egyetem
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
1901 Csolnoky Ferenc Kórház
1801 Markusovszky Egyetemi Oktatókórház
1501 Szabolcs-Szatmár-Bereg megyei Kórházak és Egyetemi Oktatókórház
21. 01349 Mamma protézis
Elszámolásra jogosult intézetek:
0301 Bács-Kiskun Megyei Kórház
0801 Petz Aladár Megyei Oktató Kórház, Győr
0802 Soproni Erzsébet Oktató Kórház és Rehabilitációs Intézet
1309 Pest Megyei Flór Ferenc Kórház
1401 Somogy Megyei Kaposi Mór Oktató Kórház
1701 Tolna Megyei Balassa János Kórház
0109 Egyesített Szent István és Szent László Kórház-Rendelőintézet
0106 Szent János Kórház és Észak-Budai Egyesített Kórházak
0101 Szent Imre Kórház
0118 Uzsoki utcai Kórház
0940 Debreceni Egyetem Klinikai Központ
0154 Országos Onkológiai Intézet
0242 Pécsi Tudományegyetem Klinikai Központ
0140 Semmelweis Egyetem
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
01A6 Magyar Honvédség Egészségügyi Központ, Budapest
01E8 Szent Margit Kórház
0509 Miskolci Semmelweis Kórház és Egyetemi Oktatókórház
1501 Szabolcs-Szatmár-Bereg megyei Kórházak és Egyetemi Oktatókórház
0901 Kenézy Gyula Kórház és Rendelőintézet
22. 01350 Tissue expander, extender
Elszámolásra jogosult intézetek:
0301 Bács-Kiskun Megyei Kórház
0502 Borsod-Abaúj-Zemplén Megyei Kórház és Egyetemi Oktató Kórház
1309 Pest Megyei Flór Ferenc Kórház
1401 Somogy Megyei Kaposi Mór Oktató Kórház
1701 Tolna Megyei Balassa János Kórház
0123 Magyarországi Református Egyház Bethesda Gyermekkórháza
0122 Heim Pál Gyermekkórház
0109 Egyesített Szent István és Szent László Kórház-Rendelőintézet
0106 Szent János Kórház és Észak-Budai Egyesített Kórházak
0101 Szent Imre Kórház
0940 Debreceni Egyetem Klinikai Központ
0154 Országos Onkológiai Intézet
0242 Pécsi Tudományegyetem Klinikai Központ
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
01A6 Magyar Honvédség Egészségügyi Központ, Budapest
01E8 Szent Margit Kórház
1501 Szabolcs-Szatmár-Bereg megyei Kórházak és Egyetemi Oktatókórház
23. 01351 Mély-rectum és nyelőcső műtétek során használt anastomosis-varrógépek és tárak
Elszámolásra jogosult intézetek:
0302 Bajai Szent Rókus Kórház
0301 Bács-Kiskun Megyei Kórház
0401 Békés Megyei Pándy Kálmán Kórház
0402 Dr. Réthy Pál Kórház-Rendelőintézet
0502 Borsod-Abaúj-Zemplén Megyei Kórház és Egyetemi Oktató Kórház
0602 Csongrád Megyei Egészségügyi Ellátó Központ Hódmezővásárhely – Makó
0701 Fejér Megyei Szent György Egyetemi Oktató Kórház
0801 Petz Aladár Megyei Oktató Kórház, Győr
0802 Soproni Erzsébet Oktató Kórház és Rehabilitációs Intézet
1102 Vaszary Kolos Kórház, Esztergom
1101 Szent Borbála Kórház, Tatabánya
1202 Dr. Kenessey Albert Kórház-Rendelőintézet
1201 Szent Lázár Megyei Kórház
1309 Pest Megyei Flór Ferenc Kórház
1401 Somogy Megyei Kaposi Mór Oktató Kórház
1402 Siófoki Kórház-Rendelőintézet
1601 Jász-Nagykun-Szolnok Megyei Hetényi Géza Kórház Rendelőintézet
1701 Tolna Megyei Balassa János Kórház
1912 Magyar Imre Kórház
1903 Gróf Esterházy Kórház és Rendelőintézet Szakrendelő
2001 Zala Megyei Kórház
2002 Kanizsai Dorottya Kórház
0112 Bajcsy-Zsilinszky Kórház és Rendelőintézet
0122 Heim Pál Gyermekkórház
0109 Egyesített Szent István és Szent László Kórház-Rendelőintézet
0115 Jahn Ferenc Dél-Pesti Kórház és Rendelőintézet
0106 Szent János Kórház és Észak-Budai Egyesített Kórházak
0116 Péterfy Sándor utcai Kórház-Rendelőintézet és Baleseti Központ
0101 Szent Imre Kórház
0121 Károlyi Sándor Kórház
0118 Uzsoki utcai Kórház
0643 Debreceni Egyetem Klinikai Központ
0154 Országos Onkológiai Intézet
0242 Pécsi Tudományegyetem Klinikai Központ
0140 Semmelweis Egyetem, Budapest
0940 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
01A6 Magyar Honvédség Egészségügyi Központ, Budapest
2237 Budai Irgalmasrendi Kórház
0702 Szent Pantaleon Kórház - Rendelőintézet, Dunaújváros
01E8 Szent Margit Kórház
1703 Dombóvári Szent Lukács Kórház
1011 Markhot Ferenc Oktatókórház és Rendelőintézet
0509 Miskolci Semmelweis Kórház és Egyetemi Oktatókórház
0306 Kiskunhalasi Semmelweis Kórház
13B2 Toldy Ferenc Kórház és Rendelőintézet
1901 Csolnoky Ferenc Kórház
1801 Markusovszky Egyetemi Oktatókórház
1501 Szabolcs-Szatmár-Bereg megyei Kórházak és Egyetemi Oktatókórház
0901 Kenézy Gyula Kórház és Rendelőintézet
24. 0135C Nyílt tüdőműtét során használt varrógépek és tárak
Elszámolásra jogosult intézetek:
0301 Bács-Kiskun Megyei Kórház
0801 Petz Aladár Megyei Oktató Kórház, Győr
1401 Somogy Megyei Kaposi Mór Oktató Kórház
1601 Jász-Nagykun-Szolnok Megyei Hetényi Géza Kórház Rendelőintézet
0112 Bajcsy-Zsilinszky Kórház és Rendelőintézet
0122 Heim Pál Gyermekkórház
0940 Debreceni Egyetem Klinikai Központ
0156 Országos Korányi TBC és Pulmonológiai Intézet
0154 Országos Onkológiai Intézet
0242 Pécsi Tudományegyetem Klinikai Központ
0140 Semmelweis Egyetem, Budapest
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
01A6 Magyar Honvédség Egészségügyi Központ, Budapest
0509 Miskolci Semmelweis Kórház és Egyetemi Oktatókórház
1801 Markusovszky Egyetemi Oktatókórház
25. 0135E Egyszer használatos eszköz vacuum core biopszia (VCB) Mammotome-hoz
Elszámolásra jogosult intézetek:
01A6 Magyar Honvédség Egészségügyi Központ, Budapest
26. 0135F Video-thoracoscopos mellkasi (VATS) műtétek során használt varrógépek és tárak
Elszámolásra jogosult intézetek:
0154 Országos Onkológiai Intézet
0156 Országos Korányi TBC és Pulmonológiai Intézet
0242 Pécsi Tudományegyetem Klinikai Központ
0643 Debreceni Egyetem Klinikai Központ
0940 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
1601 Jász-Nagykun-Szolnok Megyei Hetényi Géza Kórház Rendelőintézet
1801 Markusovszky Egyetemi Oktatókórház
27. 0135G Kolorectalis laparoszkopós bélműtétek során használt varrógépek, tárak és kiegészítő eszközök
Elszámolásra jogosult intézetek:
1701 Tolna Megyei Balassa János Kórház
0301 Bács-Kiskun Megyei Kórház
0112 Bajcsy-Zsilinszky Kórház és Rendelőintézet
0401 Békés Megyei Pándy Kálmán Kórház
0502 Borsod-Abaúj-Zemplén Megyei Kórház és Egyetemi Oktató Kórház
1901 Csolnoky Ferenc Kórház
0643 Debreceni Egyetem Klinikai Központ
0109 Egyesített Szent István és Szent László Kórház-Rendelőintézet
0901 Kenézy Gyula Kórház és Rendelőintézet
0509 Miskolci Semmelweis Kórház és Egyetemi Oktatókórház
0154 Országos Onkológiai Intézet
0242 Pécsi Tudományegyetem Klinikai Központ
1309 Pest Megyei Flór Ferenc Kórház
0801 Petz Aladár Megyei Oktató Kórház, Győr
0140 Semmelweis Egyetem, Budapest
1401 Somogy Megyei Kaposi Mór Oktató Kórház
0802 Soproni Erzsébet Oktató Kórház és Rehabilitációs Intézet
1501 Szabolcs-Szatmár-Bereg megyei Kórházak és Egyetemi Oktatókórház
0940 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
1101 Szent Borbála Kórház
0101 Szent Imre Kórház
0118 Uzsoki utcai Kórház
2001 Zala Megyei Kórház
1202 Dr. Kenessey Albert Kórház-Rendelőintézet
28. 0135K Húgyhólyag laparoszkopós bélműtétek során használt varrógépek, tárak és kiegészítő eszközök
Elszámolásra jogosult intézetek:
0140 Semmelweis Egyetem, Budapest
0940 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
0242 Pécsi Tudományegyetem Klinikai Központ
0643 Debreceni Egyetem Klinikai Központ
0115 Jahn Ferenc Dél-Pesti Kórház és Rendelőintézet
0116 Péterfy Sándor utcai Kórház-Rendelőintézet és Baleseti Központ
0502 Borsod-Abaúj-Zemplén Megyei Kórház és Egyetemi Oktató Kórház
1801 Markusovszky Egyetemi Oktatókórház
29. 01360 Injektálható implantátum a vesico-ureterális reflux és az inkontinencia kezeléséhez
Elszámolásra jogosult intézetek:
0502 Borsod-Abaúj-Zemplén Megyei Kórház és Egyetemi Oktató Kórház
0801 Petz Aladár Megyei Oktató Kórház, Győr
0123 Magyarországi Református Egyház Bethesda Gyermekkórháza
0122 Heim Pál Gyermekkórház
0940 Debreceni Egyetem Klinikai Központ
0242 Pécsi Tudományegyetem Klinikai Központ
0140 Semmelweis Egyetem, Budapest
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
01A6 Magyar Honvédség Egészségügyi Központ, Budapest
30. 01370 Végtagmegőrző endoprotézis (rosszindulatú alapbetegség kezelésében)
Elszámolásra jogosult intézetek:
0940 Debreceni Egyetem Klinikai Központ
0242 Pécsi Tudományegyetem Klinikai Központ
0140 Semmelweis Egyetem, Budapest
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
31. Biológiai implantátum (konzerv csont, porc, ín, szaruhártya, keratinocyta, egyéb)
31/a. 01401 Biológiai implantátum (konzerv csont)
Elszámolásra jogosult intézetek:
0242 Pécsi Tudományegyetem Klinikai Központ
0801 Petz Aladár Megyei Oktató Kórház, Győr
0116 Péterfy Sándor utcai Kórház-Rendelőintézet és Baleseti Központ
0140 Semmelweis Egyetem, Budapest
31/b. 01402 Biológiai implantátum (porc)
Elszámolásra jogosult intézetek:
0242 Pécsi Tudományegyetem Klinikai Központ
0801 Petz Aladár Megyei Oktató Kórház, Győr
0116 Péterfy Sándor utcai Kórház-Rendelőintézet és Baleseti Központ
0140 Semmelweis Egyetem, Budapest
31/c. 01403 Biológiai implantátum (ín)
Elszámolásra jogosult intézetek:
0242 Pécsi Tudományegyetem Klinikai Központ
0801 Petz Aladár Megyei Oktató Kórház, Győr
0116 Péterfy Sándor utcai Kórház-Rendelőintézet és Baleseti Központ
0140 Semmelweis Egyetem, Budapest
31/d. 01404 Biológiai implantátum (szaruhártya)
Elszámolásra jogosult intézetek:
0112 Bajcsy-Zsilinszky Kórház és Rendelőintézet
0940 Debreceni Egyetem Klinikai Központ
0242 Pécsi Tudományegyetem Klinikai Központ
0140 Semmelweis Egyetem, Budapest
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
1801 Markusovszky Egyetemi Oktatókórház
31/e. 01405 Biológiai implantátum (keratinocyta)
Elszámolásra jogosult intézetek:
0801 Petz Aladár Megyei Oktató Kórház, Győr
31/f. 01407 Biológiai implantátum (konzervált amnion)
Elszámolásra jogosult intézetek:
0112 Bajcsy-Zsilinszky Kórház és Rendelőintézet
0940 Debreceni Egyetem Klinikai Központ
0242 Pécsi Tudományegyetem Klinikai Központ
0140 Semmelweis Egyetem, Budapest
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
31/g. 01409 Biológiai implantátum, egyéb (kivétel: csont, porc, ín szaruhártya, keratinocyta)
Elszámolásra jogosult intézetek:
0801 Petz Aladár Megyei Oktató Kórház, Győr
0116 Péterfy Sándor utcai Kórház-Rendelőintézet és Baleseti Központ
0242 Pécsi Tudományegyetem Klinikai Központ
0140 Semmelweis Egyetem, Budapest
32. 01501 Aorta stent-graftok
Elszámolásra jogosult intézetek:
0502 Borsod-Abaúj-Zemplén Megyei Kórház és Egyetemi Oktató Kórház
0801 Petz Aladár Megyei Oktató Kórház, Győr
0242 Pécsi Tudományegyetem Klinikai Központ
0140 Semmelweis Egyetem, Budapest
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
01A6 Magyar Honvédség Egészségügyi Központ, Budapest
33. 01502 Szembetegségek kezeléséhez szükséges Ruthenium applikátor
Elszámolásra jogosult intézetek:
0940 Debreceni Egyetem Klinikai Központ
34. 01503 Műanyag keratoprotézis
Elszámolásra jogosult intézetek:
0940 Debreceni Egyetem Klinikai Központ
0140 Semmelweis Egyetem, Budapest
35. 01505 Percután rádiófrekvenciás máj-tumor ablációs eszköz
Elszámolásra jogosult intézetek:
0801 Petz Aladár Megyei Oktató Kórház, Győr
2001 Zala Megyei Kórház
0116 Péterfy Sándor utcai Kórház-Rendelőintézet és Baleseti Központ
0101 Szent Imre Kórház
0940 Debreceni Egyetem Klinikai Központ
0154 Országos Onkológiai Intézet
0242 Pécsi Tudományegyetem Klinikai Központ
0140 Semmelweis Egyetem, Budapest
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
01A6 Magyar Honvédség Egészségügyi Központ, Budapest
36. 01506 Baclofen-pumpa
Elszámolásra jogosult intézetek:
0940 Debreceni Egyetem Klinikai Központ
0163 Országos Klinikai Idegtudományi Intézet
0242 Pécsi Tudományegyetem Klinikai Központ
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
37. 01507 Légúti stentek
Elszámolásra jogosult intézetek:
0701 Fejér Megyei Szent György Egyetemi Oktató Kórház
0156 Országos Korányi TBC és Pulmonológiai Intézet
38. Neuropacemaker
38/a. 01508 Mély agyi stimulátor (pacemaker)
38/b. 01520 Gerincvelői stimulátor (pacemaker)
Elszámolásra jogosult intézetek:
0106 Szent János Kórház és Észak-Budai Egyesített Kórházak
0940 Debreceni Egyetem Klinikai Központ
0163 Országos Klinikai Idegtudományi Intézet
0242 Pécsi Tudományegyetem Klinikai Központ
0643 Szegedi Tudományegyetem Szent Györgyi-Albert Klinikai Központ
39. Urethra stent, ureter stent
39/a. 01509 Urethra stent
Elszámolásra jogosult intézetek:
0116 Péterfy Sándor utcai Kórház-Rendelőintézet és Baleseti Központ
0242 Pécsi Tudományegyetem Klinikai Központ
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
01A6 Magyar Honvédség Egészségügyi Központ, Budapest
39/b. 01514 Ureter stent
Elszámolásra jogosult intézetek:
0115 Jahn Ferenc Dél-Pesti Kórház és Rendelőintézet
0940 Debreceni Egyetem Klinikai Központ
0242 Pécsi Tudományegyetem Klinikai Központ
0140 Semmelweis Egyetem, Budapest
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
40. 01510 Hereprotézis
Elszámolásra jogosult intézetek:
0502 Borsod-Abaúj-Zemplén Megyei Kórház és Egyetemi Oktató Kórház
0801 Petz Aladár Megyei Oktató Kórház, Győr
0123 Magyarországi Református Egyház Bethesda Gyermekkórháza
0122 Heim Pál Gyermekkórház
0115 Jahn Ferenc Dél-Pesti Kórház és Rendelőintézet
0106 Szent János Kórház és Észak-Budai Egyesített Kórházak
0940 Debreceni Egyetem Klinikai Központ
0154 Országos Onkológiai Intézet
0242 Pécsi Tudományegyetem Klinikai Központ
0140 Semmelweis Egyetem, Budapest
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
01A6 Magyar Honvédség Egészségügyi Központ, Budapest
41. Égési sérültek ellátásához használt bőrpótló készítmények
41/a. 01515 Égési sérültek ellátásához használt Alloderm bőrpótló készítmény
Elszámolásra jogosult intézetek:
0123 Magyarországi Református Egyház Bethesda Gyermekkórháza
0109 Egyesített Szent István és Szent László Kórház-Rendelőintézet
41/b. 01516 Égési sérültek ellátásához használt Integra bőrpótló készítmény
Elszámolásra jogosult intézetek:
0123 Magyarországi Református Egyház Bethesda Gyermekkórháza
0109 Egyesített Szent István és Szent László Kórház-Rendelőintézet
42. 01517 Vékonybél endoszkópos kapszula
Elszámolásra jogosult intézetek:
0301 Bács-Kiskun Megyei Kórház
0401 Békés Megyei Pándy Kálmán Kórház
0502 Borsod-Abaúj-Zemplén Megyei Kórház és Egyetemi Oktató Kórház
0701 Fejér Megyei Szent György Egyetemi Oktató Kórház
0801 Petz Aladár Megyei Oktató Kórház, Győr
1102 Vaszary Kolos Kórház, Esztergom
1401 Somogy Megyei Kaposi Mór Oktató Kórház
0122 Heim Pál Gyermekkórház
0106 Szent János Kórház és Észak-Budai Egyesített Kórházak
0940 Debreceni Egyetem Klinikai Központ
0242 Pécsi Tudományegyetem Klinikai Központ
0140 Semmelweis Egyetem, Budapest
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
01A6 Magyar Honvédség Egészségügyi Központ, Budapest
1801 Markusovszky Egyetemi Oktatókórház
0116 Péterfy Sándor utcai Kórház-Rendelőintézet és Baleseti Központ
43. Antiglaucoma implantátum
43/a. 01518 Antiglaucoma shunt implantátum
Elszámolásra jogosult intézetek:
0140 Semmelweis Egyetem
0242 Pécsi Tudományegyetem Klinikai Központ
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
0940 Debreceni Egyetem Klinikai Központ
43/b. 01519 Antiglaucoma fascia lata implantátum
Elszámolásra jogosult intézetek:
0140 Semmelweis Egyetem
0242 Pécsi Tudományegyetem Klinikai Központ
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
0940 Debreceni Egyetem Klinikai Központ
44. 01600 Beültethető szívmonitor
Elszámolásra jogosult intézetek:
0502 Borsod-Abaúj-Zemplén Megyei Kórház és Egyetemi Oktató Kórház
1601 Jász-Nagykun-Szolnok Megyei Hetényi Géza Kórház Rendelőintézet
2001 Zala Megyei Kórház
1968 Balatonfüredi Állami Szívkórház
0940 Debreceni Egyetem Klinikai Központ
0162 Gottsegen György Országos Kardiológiai Intézet
0242 Pécsi Tudományegyetem Klinikai Központ
0140 Semmelweis Egyetem
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
01A6 Magyar Honvédség Egészségügyi Központ, Budapest
2237 Budai Irgalmasrendi Kórház
13B2 Toldy Ferenc Kórház és Rendelőintézet
1501 Szabolcs-Szatmár-Bereg megyei Kórházak és Egyetemi Oktatókórház
0701 Fejér Megyei Szent György Egyetemi Oktató Kórház
0801 Petz Aladár Megyei Oktató Kórház, Győr
0802 Soproni Erzsébet Oktató Kórház és Rehabilitációs Intézet
1101 Szent Borbála Kórház, Tatabánya
1801 Markusovszky Egyetemi Oktatókórház
45. 01700 Radioterápia során fellépő orális mucositis gyógyítására és megelőzésére alkalmas bevonószer
Elszámolásra jogosult intézetek:
0118 Uzsoki utcai Kórház
0154 Országos Onkológiai Intézet
0242 Pécsi Tudományegyetem Klinikai Központ
0301 Bács-Kiskun Megyei Kórház
0401 Békés Megyei Pándy Kálmán Kórház
0502 Borsod-Abaúj-Zemplén Megyei Kórház és Egyetemi Oktató Kórház
0643 Debreceni Egyetem Klinikai Központ
0940 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
1801 Markusovszky Egyetemi Oktatókórház”
”
2. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
„0301 Bács-Kiskun Megyei Kórház, Kecskemét”
„0123 Magyarországi Református Egyház Bethesda Gyermekkórháza, Budapest”
„TÁMOGATOTT INDIKÁCIÓK:
Onkológiai sebészeti szakvéleménnyel igazoltan inoperálibilis – miután a véleményező team megbizonyosodott a daganat KRAS és NRAS státusáról – vad típusú metasztatikus colorectalis carcinoma elsővonalbeli kezelésére, FOLFOX vagy FOLFIRI kemoterápiával kombinálva, azon egyszervi, illetve – a megfelelő kompetenciájú, azaz a döntéshez szükséges specialitásokat képviselő szakorvosokból álló onkológiai team döntése alapján – kétszervi parenchimás érintettséggel rendelkező betegeknél, akik a kezeléssel potenciálisan operábilissá válhatnak. Az onkoteamben részvevő szakorvosok véleményüket írásban rögzítik, és aláírásukkal azt hitelesítik. Az elsővonalbeli kezelés az operálhatóság eléréséig folytatható, azonban resectiós műtét hiányában maximum 6 hónapig, ezt követően az operálhatóság újraértékelése szükséges, inoperabilitás esetén a 8/e3.1. pont szerint folytatható az ellátás.”
„TÁMOGATOTT INDIKÁCIÓK:
Onkológiai sebészeti szakvéleménnyel igazoltan inoperálibilis – miután a véleményező team megbizonyosodott a daganat KRAS és NRAS státusáról – vad típusú metasztatikus colorectalis carcinoma elsővonalbeli kombinációs kezelésére azon egyszervi, illetve – a megfelelő kompetenciájú, azaz a döntéshez szükséges specialitásokat képviselő szakorvosokból álló onkológiai team döntése alapján – kétszervi parenchimás érintettséggel rendelkező betegeknél alkalmazható, akik a kezeléssel potenciálisan operábilissá válhatnak. Az onkoteamben részvevő szakorvosok véleményüket írásban rögzítik, és aláírásukkal azt hitelesítik. Az elsővonalbeli kezelés az operálhatóság eléréséig folytatható, azonban resectiós műtét hiányában maximum 6 hónapig, ezt követően az operálhatóság újraértékelése szükséges, inoperabilitás esetén a 8/e3.2. pont szerint folytatható az ellátás.”
„TÁMOGATOTT INDIKÁCIÓK:
Onkológiai sebészeti szakvéleménnyel igazoltan inoperábilis metasztatikus colorectalis carcinoma elsővonalbeli kombinációs kezelésére az egyszervi, illetve – a megfelelő kompetenciájú, azaz a döntéshez szükséges specialitásokat képviselő szakorvosokból álló onkológiai team döntése alapján – kétszervi parenchimás érintettség esetén azon betegeknél alkalmazható, akik a kezeléssel potenciálisan operábilissá válhatnak. Az onkoteamben részvevő szakorvosok véleményüket írásban rögzítik, és aláírásukkal azt hitelesítik. Az elsővonalbeli kezelés az operálhatóság eléréséig folytatható, azonban resectiós műtét hiányában maximum 6 hónapig, ezt követően az operálhatóság újraértékelése szükséges, inoperabilitás esetén a 8/e3.3. pont szerint folytatható az ellátás.”
a) 6/c. pont „TÁMOGATOTT INDIKÁCIÓK:” részében a „RoActemra” szövegrész helyébe a „tocilizumab” szöveg,
b) 8/e3.1., 8/e3.2., 8/e3.3. pont „TÁMOGATOTT INDIKÁCIÓK:” részében a „3 ciklust követően” szövegrész helyébe a „8 hét után elvégzett” szöveg
lép.
3. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
1. Az R1. 2. számú melléklet „A járóbeteg-szakellátás tevékenységi kódjai” megjelölésű része a „43593” megjelölésű sort követően a következő sorral egészül ki:
(Kód |
Index |
Tevékenység megnevezése |
Pont) |
„43594 |
|
Meningococcus elleni vaccinatio |
72” |
2. Az R1. 2. számú melléklet „A járóbeteg-szakellátás tevékenységi kódjai” megjelölésű rész „99930” megjelölésű sora helyébe a következő sor lép:
(Kód |
Index |
Tevékenység megnevezése |
Pont) |
„99930 |
31 |
Kiegészítő pont onkológiai indikációjú CT, MR diagnosztika 14 napon belül történő elvégzése és rosszindulatú daganatos kórkép igazolódása esetén |
10000” |
3. Az R1. 2. számú melléklet „A járóbeteg-szakellátásban használt index/* jelzésű eljárások az alábbi intézetekben végezhetők, a szakmai feltételektől és igényektől függően az OEP-pel kötött szerződésben meghatározott mennyiségi korlátozással” megjelölésű rész 1 pont „0607” megjelölésű sora helyébe a következő sor lép:
„0643 |
Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ” |
4. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
„79981 |
|
Kemoterápia, KAB protokoll szerint (01. fázis)” |
5. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
Nagy értékű, országosan nem elterjedt műtéti eljárások, beavatkozások díjtételei
1. |
OENO |
Megnevezés |
Díjtétel (E Ft) |
|
25510 |
Cadaver donor vércsoport és virológiai vizsgálatai |
81,3 |
Elszámolásra jogosult intézetek:
0164 Országos Vérellátó Szolgálat
2. |
OENO |
Megnevezés |
Díjtétel (E Ft) |
|
26450 |
Cadaver donor immunológiai (HLA) vizsgálatai |
120 |
Elszámolásra jogosult intézetek:
0164 Országos Vérellátó Szolgálat
3. |
OENO |
Megnevezés |
Díjtétel (E Ft) |
|
35950 |
Agy PET/CT vizsgálata |
192 |
|
35960 |
Egésztest PET/CT vizsgálata |
192 |
|
35970 |
Egy testtájék PET/CT vizsgálata |
105 |
Elszámolásra jogosult intézetek:
0301 Bács-Kiskun Megyei Kórház
0940 Debreceni Egyetem Klinikai Központ
3400 ScanoMed Orvosi, Diagnosztikai, Kutató és Oktató Kft.
01A2 Pozitron-Diagnosztika Kft.
1409 Kaposvári Egyetem
A PET/CT vizsgálatért járó finanszírozási díj az alábbi indikációkban számolható el:
Indikáció megnevezése |
BNO csoport |
Fej és nyaki neopláziák |
C00-C14, C30-C32 |
Az agy és gerincvelő rosszindulatú és ismeretlen viselkedésű daganatai |
C70-72, D42-D43 |
Pajzsmirigyrák |
C73H0 |
Szoliter pulmonális nodulus differenciál-diagnosztika* |
R91H0 |
Nem-kissejtes tüdőrák (NSCPC) |
C34 |
Nyelőcsőrák |
C15 |
Colorectalis carcinoma |
C18-C21 |
Lymphoma** |
C81-C83, C8510-C8590 |
Melanoma malignum |
C43 |
Emlőrák |
C50 |
Méhnyakrák |
C53 |
Epilepszia műtét előtti kivizsgálása 18 év alatt*** |
G4000, G4030 |
Tüdőtranszplantáció előtti kivizsgálás 50 év felett**** |
D86.0; D86.1; D86.2; D86.8; D86.9; J47; I27.0; I27.8; J84.1; J84.8; J84.9; E84.0; E84.1; E84.8; E84.9; J44.0; J44.1; J44.8; J44.9; Q21.80 |
* Csak abban az esetben, ha biopszia nem végezhető és más módszerrel a diagnózis nem tisztázható |
** Non-Hodgkin lymphomáknál csak az agresszív típus esetében |
*** Csak abban az esetben, ha a betegség terápiarezisztens, a góc egyéb módon (MR) nem diagnosztizálható és a beteg műtétre vár |
**** A Tüdő Transzplantációs Bizottság támogató javaslata szükséges |
4. |
OENO |
Megnevezés |
Díjtétel (E Ft) |
|
53350 |
Tüdőátültetés |
20 000 |
Elszámolásra jogosult intézetek:
0140 Semmelweis Egyetem
5. |
OENO |
Megnevezés |
Díjtétel (E Ft) |
|
53500 |
Transzkatéteres szívbillentyű beültetés, szívbillentyűvel együtt |
5 000 |
Elszámolásra jogosult intézetek:
0140 Semmelweis Egyetem
0162 Gottsegen György Országos Kardiológiai Intézet
6. |
OENO |
Megnevezés |
Díjtétel (E Ft) |
|
53750 |
Szívátültetés |
16 000 |
Elszámolásra jogosult intézetek:
0140 Semmelweis Egyetem
0162 Gottsegen György Országos Kardiológia Intézet
7. |
OENO |
Megnevezés |
Díjtétel (E Ft) |
|
53753 |
Műszív beültetés |
425 |
Elszámolásra jogosult intézetek:
0140 Semmelweis Egyetem
0162 Gottsegen György Országos Kardiológia Intézet
8. |
|
Csontvelő transzplantáció |
|
|
OENO |
Megnevezés |
Díjtétel (E Ft) |
|
54100 |
Felnőtt allogén csontvelő transzplantáció |
24 045 |
Elszámolásra jogosult intézetek:
0109 Egyesített Szent István és Szent László Kórház-Rendelőintézet
|
OENO |
Megnevezés |
Díjtétel (E Ft) |
|
54101 |
Felnőtt autológ csontvelő transzplantáció |
12 560 |
Elszámolásra jogosult intézetek:
0109 Egyesített Szent István és Szent László Kórház-Rendelőintézet
0242 Pécsi Tudományegyetem Klinikai Központ
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
0940 Debreceni Egyetem Klinikai Központ
|
OENO |
Megnevezés |
Díjtétel (E Ft) |
|
54102 |
Gyermek allogén csontvelő transzplantáció |
24 948 |
Elszámolásra jogosult intézetek:
0109 Egyesített Szent István és Szent László Kórház-Rendelőintézet
0502 Borsod-Abaúj-Zemplén Megyei Kórház és Egyetemi Oktató Kórház
|
OENO |
Megnevezés |
Díjtétel (E Ft) |
|
54103 |
Gyermek autológ csontvelő transzplantáció |
15 480 |
Elszámolásra jogosult intézetek:
0109 Egyesített Szent István és Szent László Kórház-Rendelőintézet
0502 Borsod-Abaúj-Zemplén Megyei Kórház és Egyetemi Oktató Kórház
9. |
OENO |
Megnevezés |
Díjtétel (E Ft) |
|
54104 |
Unrelated, azaz idegen donortól származó csontvelő transzplantáció kiegészítő díja |
2 453 |
Elszámolásra jogosult intézetek:
0109 Egyesített Szent István és Szent László Kórház-Rendelőintézet
0502 Borsod-Abaúj-Zemplén Megyei Kórház és Egyetemi Oktató Kórház
10. |
OENO |
Megnevezés |
Díjtétel (E Ft) |
|
54105 |
Őssejt szelekció |
2 453 |
Elszámolásra jogosult intézetek:
0109 Egyesített Szent István és Szent László Kórház-Rendelőintézet
0940 Debreceni Egyetem Klinikai Központ
11. |
OENO |
Megnevezés |
Díjtétel (E Ft) |
|
55002 |
Albuminkezelésen alapuló szupportív májpótló kezelés |
552 |
Elszámolásra jogosult intézetek:
0140 Semmelweis Egyetem
0242 Pécsi Tudományegyetem Klinikai Központ
0109 Egyesített Szent István és Szent László Kórház-Rendelőintézet
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
0940 Debreceni Egyetem Klinikai Központ
12. |
OENO |
Megnevezés |
Díjtétel (E Ft) |
|
55040 |
Májátültetés |
16 000 |
Elszámolásra jogosult intézetek:
0140 Semmelweis Egyetem
13. |
OENO |
Megnevezés |
Díjtétel (E Ft) |
|
55285 |
Kombinált hasnyálmirigy- és veseátültetés |
9 200 |
Elszámolásra jogosult intézetek:
0140 Semmelweis Egyetem
0242 Pécsi Tudományegyetem Klinikai Központ
|
OENO |
Megnevezés |
Díjtétel (E Ft) |
14. |
|
Veseátültetés |
|
|
55551 |
Veseátültetés halottból |
4 200 |
|
55553 |
Veseátültetés élőből |
Elszámolásra jogosult intézetek:
0140 Semmelweis Egyetem
0242 Pécsi Tudományegyetem Klinikai Központ
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
0940 Debreceni Egyetem Klinikai Központ
15. |
OENO |
Megnevezés |
Díjtétel (E Ft) |
|
5812J |
Kiterjesztett gerincműtét |
2 500 |
Elszámolásra jogosult intézetek:
01A3 Budai Egészségközpont
0242 Pécsi Tudományegyetem Klinikai Központ
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
0940 Debreceni Egyetem Klinikai Központ
Kiterjesztett gerincműtétért járó finanszírozási díj az alábbi indikációkban számolható el:
Progresszív súlyos (65 fokot meghaladó), keringési és légzési elégtelenséghez vezető, mellkasi deformitással járó gerincgörbületek műtéti kezelése, intenzív ellátása.
Malignus gerincdaganat kiterjesztett műtétei, csigolyatest eltávolítással „en block” rezekcióval és tumorprotézis beültetésével, mely magában foglalja a teljes intenzív ellátást is.
A cervicothoracalis átmenet komplex elölről-hátulról történő rögzítése clavicula resectioval, illetve sternum felezéssel.
A nyaki gerinc elülső, 3 szegmentumot meghaladó rögzítése (törés, tumor vagy degeneratív megbetegedések miatt).
16. |
OENO |
Megnevezés |
Díjtétel (E Ft) |
|
5812K |
Kombinált ventro-dorsalis gerincműtét |
5 000 |
Elszámolásra jogosult intézetek:
01A3 Budai Egészségközpont
0242 Pécsi Tudományegyetem Klinikai Központ
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
0940 Debreceni Egyetem Klinikai Központ
Kombinált ventro-dorsalis gerincműtétért járó finanszírozási díj az alábbi indikációkban számolható el:
Progresszív súlyos (65 fokot meghaladó), keringési és légzési elégtelenséghez vezető, mellkasi deformitással járó gerincgörbületek kombinált ventro-dorsalis több ülésben elvégzett műtéti definitív korrekciója és stabilizációja, amely magában foglalja a release műtétet követő HALO extenziót, az 5 napot meghaladó intenzív ellátást.
Primer malignus gerincdaganat miatt több ülésben elvégzett kombinált ventro-dorsalis műtét, csigolyatest eltávolítással „en block” rezekcióval és tumorprotézis beültetésével, mely magában foglalja a teljes intenzív ellátást is.
Spinális infekció miatt ventro-dorsalis több ülésben elvégzett speciális műtét, mely magában foglalja a teljes intenzív ellátást is.
17. |
OENO |
Megnevezés |
Díjtétel (E Ft) |
|
5812L |
Kiterjesztett idegsebészeti műtétek |
2 500 |
Elszámolásra jogosult intézetek:
0163 Országos Klinikai Idegtudományi Intézet
0242 Pécsi Tudományegyetem Klinikai Központ
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
0940 Debreceni Egyetem Klinikai Központ
Kiterjesztett idegsebészeti műtétért járó finanszírozási díj az alábbi indikációkban számolható el:
Szelektív dorsalis rhizotomia (SDR) intraoperatív elektrofiziológiai monitorozással.
Az intramedullaris daganatok intraoperatív elektrofiziológiai monitorozással végzett totális eltávolítása (legalább 90%-os eltávolítás).
Az agytörzsi és axialis daganatok funkcionális MR-en és tractográfiás vizsgálaton alapuló navigációval történő totális eltávolítása (legalább 90%-os eltávolítás).
A paranasalis sinusokba, illetve az arckoponyára is terjedő kombinált transcranialis és transfacialis behatolást egyaránt igénylő egy ülésben végzett műtétek.
A clivus, illetve a clivus régió tumorainak transoralis, illetve transnasalis totális resectioja (legalább 90%-os eltávolítás).
Plexus sérültek gerincvelői ideg reimplantációja autograft használatával 3 hónapon belül.
18. |
OENO |
Megnevezés |
Díjtétel (E Ft) |
|
5812M |
Kombinált idegsebészeti műtétek |
5 000 |
Elszámolásra jogosult intézetek:
0163 Országos Klinikai Idegtudományi Intézet
0242 Pécsi Tudományegyetem Klinikai Központ
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
0940 Debreceni Egyetem Klinikai Központ
Kombinált idegsebészeti műtétért járó finanszírozási díj az alábbi indikációkban számolható el:
Több ülésben végzett szelektív dorsalis rhizotomia (SDR) intraoperatív elektrofiziológiai monitorozással, ortopédiai kiegészítő műtétekkel.
Az óriás aneurysmák transcranialis úton való lezárása hypothermiában szívmegállítás mellett.
Az óriás aneurysmák transcranialis ellátása egy ülésben végzett bypass műtéttel és ha szükséges, endovascularis intervencióval.
A craniocervicalis átmenet HALO-ban, egy ülésben történő complex rögzítése (transorális dens resectio + hátsó stabilizálás).
Súlyos craniostenosis miatt végzett rekonstrukciós műtét.
|
OENO |
Megnevezés |
Díjtétel (E Ft) |
19. |
|
Terápiás aferezis, haemaferezis |
215 |
|
88571 |
Plazmaferesis, kézi |
|
88573 |
Erythrocytaferesis, gépi |
|
88574 |
Erythrocytaferesis, kézi, 2 E |
|
88575 |
Leukaferesis I. (10-15 liter vérvolumen) |
|
88576 |
Leukaferesis II. (15-20 liter vérvolumen) |
|
88577 |
Lymphocytaferesis |
|
88578 |
PBSC aferesis |
|
88579 |
Thrombocytaferesis, gépi |
|
88580 |
Plazmacsere I. (40 ml/kg, subst. FFP + Albumin) |
|
88581 |
Plazmacsere II. (60 ml/kg, subst. Albumin + HES) |
|
88582 |
Plazmacsere III. (40 ml/kg, subst. Albumin + HES) |
|
88583 |
Kryoferesis (subst. autológ kryo felülúszó) |
|
88587 |
Szelektív plazmaferezis |
215 |
Elszámolásra jogosult intézetek:
0101 Szent Imre Kórház
0106 Szent János Kórház és Észak-Budai Egyesített Kórházak
0109 Egyesített Szent István és Szent László Kórház-Rendelőintézet
0115 Jahn Ferenc Dél-Pesti Kórház és Rendelőintézet
0140 Semmelweis Egyetem
0164 Országos Vérellátó Szolgálat
0242 Pécsi Tudományegyetem Klinikai Központ
0301 Bács-Kiskun Megyei Kórház
0502 Borsod-Abaúj-Zemplén Megyei Kórház és Egyetemi Oktató Kórház
0643 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
0701 Fejér Megyei Szent György Egyetemi Oktató Kórház
0940 Debreceni Egyetem Klinikai Központ
10E8 Szent Margit Kórház
1401 Somogy Megyei Kaposi Mór Oktató Kórház
1501 Szabolcs-Szatmár-Bereg megyei Kórházak és Egyetemi Oktatókórház
0633 SZOTE Gyermekművese Állomásért Alapítvány
2220 HAEMOBIL Kft.
2239 FRESENIUS MEDICAL CARE Dialízis Center Kft.
20. |
OENO |
Megnevezés |
Díjtétel (E Ft) |
|
88584 |
Fotoferezis |
310 |
Elszámolásra jogosult intézetek:
0109 Egyesített Szent István és Szent László Kórház-Rendelőintézet
0140 Semmelweis Egyetem
0940 Debreceni Egyetem Klinikai Központ
”
6. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
7. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
|
[Ellátási forma megnevezése |
Havi fix összegű díjazás mértéke (Ft/hó)] |
„
6. |
Gyermek fül-orr-gégészeti sürgősségi centrum |
3 000 000 |
”
„A 6. pont szerinti fix díjra a Heim Pál Gyermekkórház jogosult.”
8. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
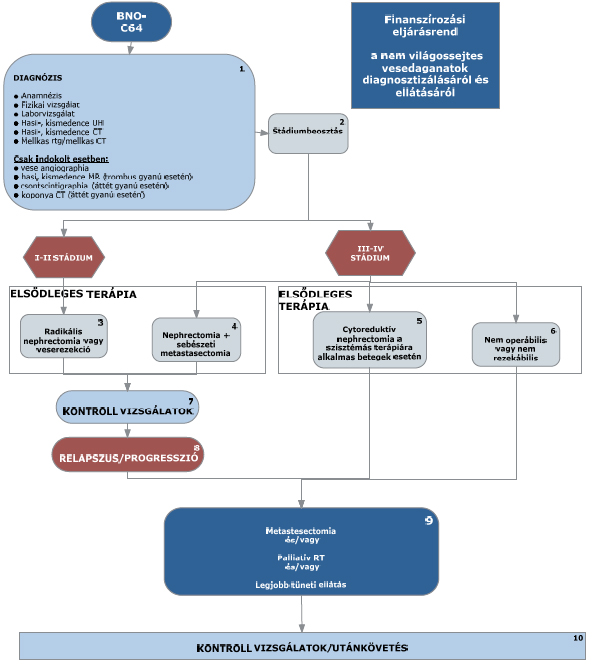
A nem világossejtes vesedaganatok diagnosztikájának és kezelésének finanszírozási eljárásrendje
1. Az eljárásrend tárgyát képező betegség, betegcsoport megnevezése
1.1. Daganatos megbetegedések (C00-C97)
1.1.1. Vese rosszindulatú daganatai
1.1.1.1. Nem világossejtes daganatok
2. A kórkép leírása
2.1. A vese rosszindulatú daganatainak előfordulási gyakorisága az utóbbi évtizedekben lassan emelkedik. A Magyar Rákregiszter adatai alapján 2012-ben 1384 új megbetegedés fordult elő. Leggyakrabban 45-70 éves életkor között jelentkezik, de egyre gyakoribb fiatalabb életkorban is.
A malignus vesedaganatok között a leggyakoribb a vesesejtes carcinoma (RCC), mely a vesekéregben alakul ki, a proximális kanyarulatos csatornákat bélelő sejtekből. A vesesejtes ráknak 5 fő altípusa különböztethető meg, amelyek közül a leggyakoribb a világos sejtes veserák (az esetek 75-80%-a). A papilláris carcinoma I-II 12-14%-ban, a cromophob carcinoma 4-6%-ban, az oncocyter típusú vesesejtes rák 2-4%-ban, míg a Bellini-féle carcinoma 1%-ban figyelhető meg. A szövettani diagnózis ismerete mindig kötelező. A tumor terjedése részben lokálisan, részben pedig a nyirok- és vérerek útján történik.
A betegség etiológiája pontosan még nem ismert, de mind a hazai, mind a jelentősebb nemzetközi szakmai társaságok kiemelik a dohányzás szerepét az RCC kialakulásában (2A evidencia szint). A szakmai evidenciák alapján az elhízás, a kávéfogyasztás és az állati zsiradékok fogyasztása is komoly rizikófaktornak tekinthető. Felfedezéskor 60-70%-ban szervre lokalizált, 5-10%-ban lokálisan előrehaladott, 15-20%-ban távoli áttétet képez. Relapszus a korai I-II klinikai stádiumban is előfordul.
2.2. A vesedaganatok stádium beosztása során a következő TNM klasszifikációt alkalmazzuk:
2.2.1. TNM klinikai klasszifikáció, primer tumor
T |
Primer tumor |
TX |
Primer tumor nem ítélhető meg |
T0 |
Primer tumor nem mutatható ki |
T1 |
A tumor a vese anatómiai határain belül helyezkedik el, a legnagyobb dimenziójában maximum 7 cm |
T1a |
4 cm-es vagy kisebb tumor |
T1b |
4 cm-nél nagyobb, 7 cm-nél nem nagyobb tumor |
T2 |
A tumor a vese anatómiai határain belül helyezkedik el, a legnagyobb dimenziójában meghaladja a 7 cm-t |
T2a |
A tumor a vese anatómiai határain belül helyezkedik el, a legnagyobb dimenziójában meghaladja a 7 cm-t, de 10 cm-nél nem nagyobb |
T2b |
A tumor 10 cm-nél nagyobb, de a vese anatómai határait nem haladja meg |
T3 |
A tumor ráterjed a nagyobb vénákra [vena renalis(ok)], infiltrálja a perirenalis (más szóval perinephricus) szöveteket, de nem terjed túl a Gerota-fascián és nem infiltrálja a mellékvesét |
pT3a |
A daganat szabad szemmel látható módon a v. renalis-ban, vagy annak nagy szegmentális ágaiban terjed (szövettan: a venának van izmos fala), vagy a perinephricus, illetve a vesemedencei zsírszövetbe terjed |
pT3b |
A daganat szabad szemmel észlelhetően beterjed a v. cava-ba, de a növedék nem haladja meg a rekeszizom szintjét |
pT3c |
A daganat szabad szemmel észlehetően beterjed a v. cava-ba, és a növedék a rekeszizom vonalát meghaladja, vagy a tumor beszűri a v. cava falát |
pT4 |
A tumor túlterjed a Gerota-fascián (ideértve, ha közvetlen terjedés révén beszűri a mellékvesét) |
2.2.2. TNM klinikai klasszifikáció, Regionális nyirokcsomó
N |
Regionális nyirokcsomók |
NX |
Regionális nyirokcsomóáttét nem igazolható |
N0 |
Nincs regionális nyirokcsomóáttét |
N1 |
Metastasis szoliter regionális nyirokcsomóban |
N2 |
Metastasis egynél több regionális nyirokcsomóban |
2.2.3. TNM klinikai klasszifikáció, Távoli áttétek
M |
Távoli áttétek |
M0 |
Távoli áttét nincs |
M1 |
Távoli áttét(ek) |
2.2.4. G Szövettani grading
G |
Szövettani grading |
|
Fuhrmann Grádus |
Sejtmag mérete |
Sejtmag alakja |
Nucleolus |
G1 |
Jól differenciált |
Kicsi (10 um) |
Szabályos |
Nem észlelhető |
G2 |
Mérsékelten differenciált |
Kicsi; valamivel nagyobb (15 um) |
Szabálytalan |
40x nagyításnál megfigyelhető |
G3 |
Gyengén differenciált |
Közepesen nagy (20 um) |
Szabálytalan |
10x nagyításnál megfigyelhető |
G4 |
Differenciálatlan |
IV Nagy |
Bizarr |
Feltűnő |
3. Finanszírozás rendje, finanszírozási algoritmus
3.1. (4, 5): IV. stádiumban nephrectomia, ha a beteg jó általános állapotú.
3.2. (5, 6): pT3-pT4 indokolt eseteiben (tumor műtéti sérülése) posztoperatív irradiatió; nem műthető csontáttét esetén RANK ligand gátló vagy bisfosfonat kezelés, indokolt esetben irradiatió javasolt.
3.3. (7, 10): Kontroll vizsgálat az I-II stádiumban az első két évben legalább 6 havonta, majd a 3-5. évig legalább évente esedékes. A kontroll vizsgálat során fizikális vizsgálat, teljes labor, mellkas RTG, hasi-kismedencei UH vizsgálat végzendő. Amennyiben indokolt, mellkas CT, hasi, kismedencei CT/MR javasolt.
3.4. (8): A relapszust minden esetben igazolni kell (valamely képalkotó eljárással) és dokumentálni szükséges.
3.5. (9): Lokális recidíva esetén, amennyiben technikailag lehetséges, sebészi eltávolítás javasolt.
Irrezekábilis esetekben, ha korábban nem volt sugárkezelés, irradiatió szóba jön.
A radioterápia a szakma szabályai szerint történik.
3.6. (10): Az utánkövetés a 3.3. pontban leírtak szerint történik.
4. A finanszírozási szakmai ellenőrzés alapját képező ellenőrzési sarokpontok
4.1. A finanszírozási ellenőrzés során elsődlegesen azt vizsgáljuk, hogy a kezelő orvosok betartják-e a kihirdetett finanszírozási rendet, különös tekintettel a következő főbb sarokpontokra:
4.1.1. A szövettani típus megfelelően dokumentált?
4.1.2. Stádiumbeosztásra vonatkozó adatok megtalálhatóak-e?
4.1.3. A relapszus/progesszió igazolt és megfelelően dokumentált?
5. A finanszírozási eljárásrend alkalmazásának hatását mérő minőségi indikátorok
5.1. A finanszírozási eljárásrend hatását a következő indikátorokkal kívánjuk mérni:
5.1.1. A területre fordított közkiadások alakulása.
5.1.2. A helyes, finanszírozott algoritmus szerint kezelt betegek aránya.
6. A finanszírozás szempontjából lényeges finanszírozási kódok
6.1. Releváns BNO kódok
|
A |
B |
1 |
BNO |
BNO megnevezése |
2 |
C64H0 |
A vese rosszindulatú daganata, kivéve a vesemedencét |
6.2. Releváns OENO kódok
|
A |
B |
1 |
OENO |
OENO megnevezése |
2 |
11041 |
Vizsgálat |
3 |
36135 |
Vese UH vizsgálata |
4 |
36130 |
Hasi, kismedencei UH (áttekintő, komplex) UH vizsgálat |
5 |
34450 |
Teljes has CT vizsgálata natív |
6 |
31310 |
Mellkasfelvétel, AP/PA |
7 |
31311 |
Mellkasfelvétel, oldalirányú |
8 |
31312 |
Mellkasfelvétel, kétirányú |
9 |
31380 |
Mellkasfelvétel, célzott |
10 |
3617D |
Duplex UH, vese |
11 |
34454 |
Teljes has és medence CT vizsgálata natív és iv. kontrasztanyag adását követőleg |
12 |
34442 |
Mellkas CT vizsgálata natív plusz iv. kontrasztanyag adását követőleg |
13 |
34935 |
Teljes has MR vizsgálata natív plusz iv. kontrasztanyag adását követőleg |
14 |
3532G |
Vese angioszcintigráfia (indokolt esetben) |
15 |
3533A |
3 fázisú csontszcintigráfia (indokolt esetben)
|
16 |
34410 |
Agykoponya natív CT vizsgálata |
17 |
34411 |
Agykoponya CT vizsgálat iv. kontrasztanyag adását követőleg |
18 |
34412 |
Agykoponya CT vizsgálat natív plusz iv. kontrasztanyag adását követőleg |
19 |
14810 |
Biopsia parietis abdominis |
20 |
|
Laborvizsgálatok |
6.3. Releváns kemoterápiás protokollok
|
A |
B |
1 |
Kód |
Kemoterápiás protokoll megnevezése |
2 |
7051 |
Kemoterápia, GEM+CDDP I. protokoll szerint |
3 |
7316 |
Kemoterápia, VIP/J Carboplatinnal protokoll szerint |
4 |
7317 |
Kemoterápia, CMV protokoll szerint |
5 |
7318 |
Kemoterápia, INF-alfa+IL2+5FU protokoll szerint |
6 |
7320 |
Kemoterápia, GEM+CBP/C protokoll szerint |
7 |
7727 |
Kemoterápia, SIVD2+dexrazoxane protokoll szerint 18 év alatt |
8 |
7728 |
Kemoterápia, SCErV+dexrazoxane protokoll szerint 18 év alatt |
9 |
7729 |
Kemoterápia, WTVAER+dexrazoxane protokoll szerint 18 év alatt |
10 |
7744 |
Kemoterápia, WTVER+dexrazoxane protokoll szerint 18 év alatt |
11 |
7913 |
Immunterápia, VBL+interferon protokoll szerint |
12 |
7948 |
Kemoterápia, SV protokoll szerint 18 év alatt |
13 |
7949 |
Kemoterápia, SVA protokoll szerint 18 év alatt |
14 |
7950 |
Kemoterápia, SIVA2 protokoll szerint 18 év alatt |
15 |
7951 |
Kemoterápia, SIVD2 protokoll szerint 18 év alatt |
16 |
7952 |
Kemoterápia, SIVA3 protokoll szerint 18 év alatt |
17 |
7953 |
Kemoterápia, SCErV protokoll szerint 18 év alatt |
18 |
7954 |
Kemoterápia, SI3VE protokoll szerint 18 év alatt |
19 |
7955 |
Kemoterápia, SICARE5 protokoll szerint 18 év alatt |
20 |
7956 |
Kemoterápia, WV protokoll szerint 18 év alatt |
21 |
7957 |
Kemoterápia, WVAct protokoll szerint 18 év alatt |
22 |
7958 |
Kemoterápia, WTVA5 protokoll szerint 18 év alatt |
23 |
7959 |
Kemoterápia, WTVA5V protokoll szerint 18 év alatt |
24 |
7960 |
Kemoterápia, WTVER protokoll szerint 18 év alatt |
25 |
7961 |
Kemoterápia, WTVAER protokoll szerint 18 év alatt |
6.4. Releváns HBCS kódok
|
A |
B |
1 |
HBCS |
HBCS megnevezése |
2 |
566B |
Vese, ureter, húgyhólyag jelentős műtétei daganat miatt, cystectomiaval és hó-lyagpótlással |
3 |
566C |
Vese, ureter, húgyhólyag jelentős műtétei daganat miatt |
4 |
577B |
Vese-, húgyúti daganatok |
5 |
9430 |
Sugárterápia |
6 |
608Z |
Vese-, húgyutak műtétei (kivéve: jelentős műtétek) súlyos társult betegséggel |
7 |
610Z |
Vese-, húgyúti betegségek (kivéve: veseelégtelenség, a vese, húgyutak egyéb belgyógyászati betegségei cytostatikus vagy cyclosporin kezeléssel) |
8 |
959A-959H, 959 J |
Rosszindulatú daganat kemoterápiája "A"-"H" és "J" |
7. Rövidítések
BNO Betegségek nemzetközi osztályozása
BSC Best supportive care
HBCS Homogén betegségcsoport
EAU European Association of Urology
OENO Orvosi eljárások nemzetközi osztályzása
RCC Vesesejtes rák
RTG Röntgen
TNM Tumor, node, metastasis (tumor, nyirokcsomó, metasztázis)
”
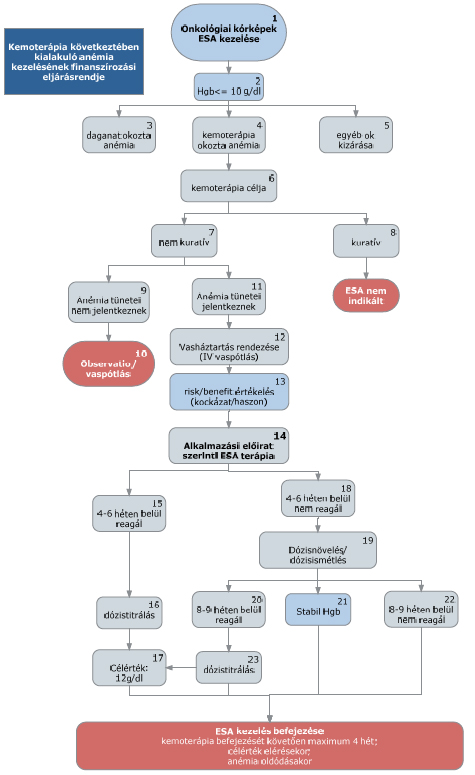
9. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
A kemoterápia következtében kialakuló anémia kezelésének finanszírozási eljárásrendje
1. Az eljárásrend tárgyát képező betegség, betegcsoport megnevezése
Daganatos megbetegedések
Az indikációs körbe került rosszindulatú daganatok: C34, C50, C56, C57, C62, C82, C83, C84, C85, C88, C90, C91
2. Kórkép leírása
A daganatos betegek körében 30-90%-os gyakoriságú kísérő tünet az anémia. Az ok részben a betegség jellege, részben az alapbetegségre alkalmazott terápia. A vérszegénység egyfelől a betegek életminőségét ronthatja jelentősen, másrészről befolyásolja a daganatellenes kezelés eredményességét.
2.1. Onkológiai kórképek során kialakult anémia etiológiája
2.1.1. A daganatos betegségek során kialakult anémia számos kórfolyamatra vezethető vissza:
2.1.1.1. daganatsejtek által kiváltott fokozott makrofág-aktiváció és következményes vörösvértest pusztulás,
2.1.1.2. bizonyos citokinek gátolják a vesében az eritropoetin termelést,
2.1.1.3. a csontvelő tumoros infiltrációja (NICHE),
2.1.1.4. a daganatsejtekből vasraktározást fokozó, csökkent vörösvérsejt termelést és rövidülő vörösvérsejt élettartamot okozó citokinek kibocsátása,
2.1.1.5. a beteg étvágyának csökkenése, emiatt bizonyos anyagok csökkent bevitele (pl: vas, folsav hiány),
2.1.1.6. vérvesztés, mely akár a tumorból, akár pedig a tumorba irányulhat,
2.1.1.7. hemolízis mechanikus (pl. DIC: fragmentációs) vagy immunológiai tényezők miatt.
2.1.2. A kemoterápiás készítmények a következő mechanizmuson keresztül okozhatnak anémiát:
2.1.2.1. direkt myeloszupresszív hatás a vörösvértest termelés gátláson keresztül,
2.1.2.2. a vesetubulusok direkt szövet károsodása során, ami az EPO termelést tovább csökkenti,
2.1.2.3. gyógyszer okozta hemolízis.
2.1.3. Egyes kemoterápiás készítmények anémiát okozó hatása még kifejezettebb. Ezek a platina-tartalmú kemoterápiák, melyeket leginkább ovarium, tüdő, fej-nyaki daganatokban alkalmaznak. Valószínűleg a tüdő és nőgyógyászati tumorokban nagyobb arányban előforduló anémia is a betegségre adott kemoterápia platina tartalmával függ össze. Az anémia objektív tünete lehet a tartós gyors szívverés, szédülés, gyors, felületes, nehézlégzés, fejfájás, személyiségváltozás, depresszió. A súlyos, pihenésre nem javuló kimerültség talán a legjellemzőbb és leggyakrabban elforduló szubjektív tünet, mely a betegek mindennapi életvitelét a leginkább ronthatja. A kimerültségnek egyéb okai is lehetnek: radioterápia, alapbetegség, szorongás, depresszió. Az alacsony haemoglobin szint az alkalmazott kemoterápia hatékonyságát csökkenti, így a várható túlélésre is kihat. Az anémia kezelése az onkológiai terápia fontos része. A daganatos betegségek okozta vérszegénység kezelésében a vörösvérsejt transzfúzió és a rekombináns DNS technológiával előállított ESA készítmények állnak rendelkezésre.
2.2. A kezelés megválasztásánál mérlegelendő szempontok
2.2.1. Transzfúzió
2.2.1.1. a rendelkezésre álló mennyiség szűkössége, kiszámíthatatlan volta,
2.2.1.2. transzfúziós reakciók: korai, késői, immunológiai és nem immunológiai okok,
2.2.1.3. vércsoport tévesztés veszélye,
2.2.1.4. vérátömlesztéssel átvihető betegségek potenciális veszélye.
2.2.2. A transzfúziós kezelés előny és hátrány mérlegelése
|
A |
B |
1 |
Előny |
Hátrány |
2 |
gyors haemoglobin emelkedés |
transzfúziós reakciók |
3 |
gyorsan csökken a beteg kimerültség érzése |
kongesztív szívelégtelenség |
4 |
|
fertőzések átvitele |
5 |
|
vastúlterhelés |
6 |
|
fokozott thromboemboliás készség |
7 |
|
csökkenő túlélés |
2.2.3. Eritropoetin készítmények
Az eritropoetin glikoprotein típusú differenciáló, mitózis-stimuláló hormon. 2-3 hét késés tapasztalható az eritropoetin alkalmazása és az eritropoetin-indukálta vörösvérsejtek megjelenése között.
2.2.4. Eritropoetin alkalmazásának előnyei és lehetséges hátrányai
|
A |
B |
1 |
Előny |
Hátrány |
2 |
transzfúziós igény csökken |
thrombotikus szövődmények |
3 |
fokozatosan csökken a beteg kimerültség érzése |
csökken a túlélés |
4 |
|
a tumor progressziójáig eltelt idő csökken |
5 |
|
hipertenzió/zavartság |
6 |
|
tiszta vörösvérsejt aplázia (PRCA) |
Az eritropoetin készítmények alkalmazása során multicentrikus vizsgálatok súlyos, az életet megrövidítő és kevésbé súlyos mellékhatásokról számoltak be. Nem bizonyított, de kizárni sem lehet biztonsággal, hogy az ESA készítmények a kissejtes tüdőrák kivételével gyorsíthatják a tumorok progresszióját. Egyéb mellékhatásokat is okozhat az eritropoetin kezelés, mint a hányinger, hasmenés, hányás; influenzaszerű tüneteket szintén leírtak. A törzskönyvi indikációs feltételek szigorú betartása, a betegek szoros monitorozása a mellékhatások előfordulásának csökkentése miatt elengedhetetlen.
3. Finanszírozás rendje, finanszírozási algoritmus
3.1. A finanszírozási algoritmus részletezése
(1): Az ESA terápia az alábbi tumoros kórképek kezelése során alkalmazható: BNO: C62, C50, C34, C82-85, 88, 90-91, C56-57.
(2): A beteg szérum Hgb szintje 10 g/dl vagy ez alatt kell, hogy legyen az ESA terápia megkezdése előtt.
3.1.1. A kezelés megkezdése előtt az anémia etiológiájának vizsgálata szükséges. Ennek során első lépésben a vérszegénység jellemzésére (retikulocitaszám és átlagos vörösvérsejt térfogat: MCV), majd a potenciálisan korrigálható etiológia tisztázására kerül sor. Az ESA készítmények kizárólag kemoterápia okozta anémia (4) kezelésére használhatók. Egyéb okok: daganat okozta (3) és egyéb más ok, pl. sugárterápia (5) miatti anémia kezelésére nincs törzskönyvezve.
3.1.2. Az alkalmazott kemoterápia célja
(6): Az ESA terápia kizárólag nem kuratív (7) céllal alkalmazott kemoterápia mellett adható.
Kuratív (8) célú kemoterápia mellett nem finanszírozott az ESA terápia. A kemoterápia célját a kezelőorvos dönti el, azonban a hererák, korai emlőtumor, a korai nem kissejtes tüdőrák primer és adjuváns kemoterápiája, a Hodgkin kór és agresszív non-Hodgkin lymphomák kezelése kuratív célúnak tekintendő, amíg az ellenkezője nem bizonyosodik be. Az ESA kezelés független indikációja a krónikus veseelégtelenség, melynek jelenléte esetén a kuratív kemoterápia időszakában is indikált lehet a szigorúan monitorozott ESA alkalmazás. Ilyenkor a kezelés beadását követően, a vesebetegség esetére vonatkozó alkalmazási előirat szerint használandó.
3.1.3. Tünetek vizsgálata
ESA kezelés során tünetekkel járó vérszegénység esetében a hemoglobin érték 8-10 g/dl, tünetmentes, stabil állapotú betegek esetében 7-9 g/dl szinten tartandó (11).
Objektív tünetek lehetnek: perifériás ödéma, tachycardia, tachypnoe. Szubjektív tünetek: mellkasi fájdalom, terhelésre jelentkező dyspnoe, fáradtság érzés, szédülés, gyengeség, fülzúgás.
(9): Amennyiben a betegnél még nem jelentkeznek tünetek és a vérszegénység nem éri el a 7 g/dl hemoglobin szintet, obszerváció és szükség szerint vaspótlás (10) javasolt.
3.1.4. Vasháztartás rendezése
(12): Az ESA terápia bevezetése előtt a beteg vasháztartását rendezni kell, és ezt a betegdokumentációban is rögzíteni szükséges. Ez történhet orális vagy parenterális vaskészítményekkel egyaránt. Mikrocitás anémia (MCV< 80 fl) esetén kötelező, egyébként ajánlott a vasháztartás vizsgálata (ferritin, transzferrin szaturáció). Abszolút vashiányra utal, ha a szérum ferritin koncentráció <30 ng/ml, transzferrin szaturáció <15%. Funkcionális vashiányra utal, ha a ferritin koncentráció ≤ 800 ng/ml és a transzferrin szaturáció <50%. Abszolút vashiányban intravénás vaskezelés szükséges, funkcionálisban az ESA kezelés mellett a vaspótlás megfontolandó. Elvethető a vashiány, ha a ferritin > 800 ng/ml vagy a transzferrin szaturáció ≥ 20%.
3.1.5. Előny és kockázat (risk/benefit) mérlegelése
(13): Az ESA terápia megkezdése csak a beteggel való közös döntés eredménye lehet. A beteget teljes körűen tájékoztatni kell a kezelés céljáról, a várható eredményekről és a kockázatokról. Általános beteg tájékoztatás során ki kell térni az ESA kezelés lehetséges mellékhatásaira. Fontos mérlegelési szempont a vérszegénység rendezésére rendelkezésre álló idő (gyorsan rendezendő esetben transzfúzió, megfelelő kritériumok esetében lassan is rendezhető esetben ESA adása jön szóba) és a transzfúzió adásával járó volumenterhelés.
3.1.6. ESA terápia megkezdése
(14): A fenti feltételek szerint az ESA terápia elkezdhető a készítmények alkalmazási előirataiban foglalt dozírozás szerint.
3.1.7. ESA terápia eredményességének megítélése a haematológiai paraméterek mentén
(15): Reagál: a szérum Hgb szint változás nagyobb, mint 1 g/dl vagy a retikulocitaszám nagyobb, mint 40 000 sejt/µl 4-6 hetes ESA terápiát követően. A 4 hét az epoetin alfa, a 6 hét a darbepoetin alfa készítményre vonatkozik. A dózistitrálás alapja a Hgb célérték fenntartása, vagyis a lehető legalacsonyabb dózisra kell a beteget beállítani, amivel még a célérték fenntartható (16-17).
(18): Nem reagál: a fenti paraméterek nem teljesülnek 4-6 hét kezelést követően. Ebben az esetben dózisemelés/dózisismétlés lehetséges (19) a gyógyszerek alkalmazási leiratai szerint, majd a hematológiai paraméterek újraértékelése következik a 8-9. héten.
3.1.8. Terápia befejezése
(20): Amennyiben az emelt dózissal 8-9 héten belül reagál (fenti kritériumok szerint), dózistitrálás (23), amennyiben szükséges, majd a célérték elérésekor (17), illetve a terápiás idő leteltével a kezelés befejezése.
(21): Amennyiben a dózisemeléssel/ismétléssel stabilan tartható a beteg haemoglobin szintje, a gyógyszeres terápia folytatható az algoritmusban meghatározott feltételekig.
(22): Amennyiben 8-9 hetes kezelést követően, dózisemelés/ismétlés mellett sem történt haematológiai válaszreakció, a kezelés felfüggesztése indokolt.
3.1.9. Az ESA kezelés befejezése: a kemoterápiás kezelést követő maximum 4. hétig; a célérték elérésekor (célérték tartása), illetve az anémia oldódásakor. A célérték elérésekor vagy annak közelében a szerek törzskönyvében előírt dózisredukcióra, a célérték meghaladásakor a kezelés felfüggesztésére lehet szükség.
4. A finanszírozás szakmai ellenőrzésének alapját képező ellenőrzési sarokpontok
4.1. Az adott indikációs körben és feltételek mellett alkalmazták-e az ESA készítményeket?
4.2. A szérum Hgb szint 10 g/dl vagy ez alatti volt a terápia megkezdésekor?
4.3. A terápia megkezdése előtt a beteg vasháztartását rendezték? (A vaspótlás szükségességét a microcytás anémia kifejezetten valószínűsíti.)
4.4. Nem kuratív céllal alkalmazott kemoterápia mellett adták-e a készítményeket? (Erről a kezelőorvos nyilatkozata szükséges.)
4.5. Az ESA terápia felfüggesztése az eljárásrend szerint, a hematológiai paraméterek mentén történt?
5. A finanszírozási eljárásrend alkalmazásának hatását mérő minőségi indikátorok
5.1. A területre fordított közkiadások alakulása.
5.2. A helyes, finanszírozott algoritmus szerint kezelt betegek aránya.
6. A finanszírozás szempontjából lényeges finanszírozási kódok
6.1. A releváns BNO kódok
|
A |
B |
1 |
BNO |
BNO megnevezés |
2 |
C62 |
Heretumor |
3 |
C50 |
Emlődaganat |
4 |
C34 |
Tüdődaganat |
5 |
C82-85 |
Malignus lymphoma |
6 |
C88 |
Malignus lymphoma |
7 |
C90-91 |
Malignus lymphoma / myeloma |
8 |
C56-57 |
Ovarium tumor |
6.2. A releváns OENO kódok
|
A |
B |
1 |
OENO |
OENO megnevezés |
2 |
11041 |
Vizsgálat |
3 |
11301 |
Kontrollvizsgálat, konzílium |
4 |
29000 |
Szövettani vizsgálat szokásos feldolgozási módszerrel |
5 |
29050 |
Szövettani vizsgálat immunhisztokémiai reakció alkalmazása esetén |
6 |
14251 |
Biopsia medullae ossealis crista ossis ilei |
7 |
3523B |
Áttekintő csontszcintigráfia |
8 |
2640N |
CD sejtszám meghatározása, antigénenként, áramlási citométerrel, egyéb fluorop |
9 |
2640L |
CD sejtszám meghatározása, antigénenként, áramlási citométerrel, FITC-el jelöl |
10 |
2640M |
CD sejtszám meghatározása, antigénenként, áramlási citométerrel, phycoerithrei |
11 |
66343 |
Vörösvérsejt koncentrátum, zárt rendszerben, szűrt, adenin tartalmú oldatban reszuszpenzió |
12 |
66290 |
Vörösvérsejt koncentrátum határréteg szegény, reszuszpendált, szerelékkel |
13 |
64125 |
Vörösvérsejt koncentrátum zárt rendszerben mosott, fiziológiás sóban vagy adenin tartalmú oldatban reszuszpendált, szerelékkel |
14 |
66290 |
Vörösvérsejt koncentrátum határréteg szegény, reszuszpendált, szerelékkel |
15 |
66343 |
Vörösvérsejt koncentrátum, zárt rendszerben, szűrt és mosott kb. 50 ml, adenin tartalmú oldatban, reszuszpendált, szerelékkel |
16 |
66344 |
Vörösvérsejt koncentrátum, zárt rendszerben, szűrt, kb. 50 ml, adenin tartalmú oldatban, reszuszpendált, szerelékkel |
17 |
66348 |
Vörösvérsejt koncentrátum, 1 E gépi aferezis, adenin tartalmú oldatban reszuszpendált, szerelékkel |
18 |
66992 |
Vörösvérsejt koncentrátum, zárt rendszerben, szűrt, mosott fiziológiás sóban vagy adenin tartalmú oldatban reszuszpendált, szerelékkel |
19 |
66993 |
Vörösvérsejt koncentrátum, fagyasztott, -196 °C, felolvasztott, szerelékkel |
20 |
69971 |
Vörösvérsejt koncentrátum, szűrt, fagyasztott, -196 °C, szerelékkel |
21 |
69972 |
Vörösvérsejt koncentrátum, zárt rendszerben, szűrt, adenin tartalmú oldatban reszuszpendált, szerelékkel |
22 |
64125 |
Vörösvérsejt koncentrátum, zárt rendszerben mosott, fiziológiás sóban vagy adenin tartalmú oldatban reszuszpendált, szerelékkel |
23 |
37008 |
Konformális besugárzás kiegészítő pontja |
24 |
37220 |
Lineáris accelerátor, foton 16 MV és a felett, egy mező |
25 |
37210 |
Lineáris accelerátor, foton 7-15 MV és a felett, egy mező |
26 |
37200 |
Lineáris accelerátor, foton 6 MV-ig, egy mező |
27 |
37007 |
Irreguláris mezős besugárzás kiegészítő pontja, egy mező |
28 |
3586A |
Pótlék: egy testtájék kiegészítő SPECT vizsgálat |
29 |
28939 |
Fluoreszcencia insitu hibridizáció (FISH) humán betegségekben |
30 |
26625 |
CA 125 |
31 |
29400 |
Diagnosztikus aspirációs/exfoliatív citológiai vizsgálat a szokásos feldolgozási módszerrel |
32 |
36130 |
Hasi (áttekintő, komplex) UH vizsgálat |
33 |
31312 |
Mellkasfelvétel, kétirányú |
34 |
31310 |
Mellkasfelvétel, AP/PA |
6.3. A releváns HBCS kódok
|
A |
B |
1 |
HBCS |
HBCS megnevezés |
2 |
492C |
Szubtotális emlőeltávolítás rosszindulatú daganat miatt, társult betegséggel |
3 |
491B |
Teljes emlőeltávolítás rosszindulatú daganat miatt, társult betegség nélkül |
4 |
491A |
Teljes emlőeltávolítás rosszindulatú daganat miatt, társult betegséggel |
5 |
506A |
Rosszindulatú emlődaganatok társult betegséggel |
6 |
506B |
Rosszindulatú emlődaganatok társult betegség nélkül |
7 |
6140 |
Here műtétei malignus betegségek miatt |
8 |
621A |
Férfi reproduktív rendszer rosszindulatú daganatai társult betegséggel |
9 |
621B |
Férfi reproduktív rendszer rosszindulatú daganatai társult betegség nélkül |
10 |
945A |
Non-Hogdkin lymphoma, nem akut leukémia kemoterápiája 18 év felett |
11 |
771D |
Lymphoma, nem akut leukémia 18 év felett |
12 |
944C |
Hodgkin-kór, Non-Hogdkin lymphoma, nem akut leukémia kemoterápiája 18 év felett, legalább 14E szűrt és besugárzott vérkészítmény adás |
13 |
6420 |
Uterus, adnex műtétei malignitás miatt |
14 |
657A |
Női reproduktív rendszer rosszindulatú daganatai társult betegséggel |
15 |
657B |
Női reproduktív rendszer rosszindulatú daganatai társult betegség nélkül |
16 |
6520 |
Női reproduktív rendszer egyéb műtétei |
17 |
1460 |
Légzőszervi daganatok |
6.4. A releváns ATC kódok
|
A |
B |
1 |
ATC |
ATC megnevezés |
2 |
B03XA01 |
Eritropoietin, epoetin alfa, epoetin theta, epoetin zéta |
7. Rövidítések
ATC: Anatomical Therapeutic Chemical klasszifikáció
BNO: Betegségek nemzetközi osztályozása
ESA: Erythropoesis stimulating agens (EPO készítmények gyűjtőfogalom)
HBCS: Homogén betegségcsoport
OENO: Orvosi eljárások nemzetközi osztályozása
”
10. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
A Parkinson betegségcsoport diagnosztikájának és kezelésének finanszírozási eljárásrendje
1. Az eljárásrend tárgyát képező betegség, betegcsoport megnevezése
Neurodegeneratív megbetegedések:
1.1. G20HO Parkinson-kór
1.2. G2110 Egyéb, gyógyszer-indukálta másodlagos parkinsonismus
1.3. G2120 Más külső tényező okozta másodlagos parkinsonismus
1.4. G2130 Agyvelőgyulladás utáni parkinsonismus
1.5. G2180 Egyéb másodlagos parkinsonismus
1.6. G2190 Másodlagos parkinsonizmus k.m.n.
2. Fogalmak
2.1. A szintű bizonyíték: Az adott beavatkozás hatásossága egyértelműen bizonyított („hatásos”). Azaz: legalább egy I. szintű vagy legalább két II. szintű vizsgálat egybehangzó eredménye támasztja alá.
2.2. B szintű bizonyíték: Az adott beavatkozás hatásossága valószínűen hatásos. Azaz: legalább egy II. szintű vagy legalább három III. szintű vizsgálat egybehangzó eredménye támasztja alá.
2.3. C szintű bizonyíték: Az adott beavatkozás hatásossága/nem hatásossága lehetséges. Azaz legalább két III. szintű vizsgálat meggyőző és egybehangzó eredménye támasztja alá.
2.4. Bradykinézia/hypokinézia: A mozgás sebességének, amplitúdójának csökkenése, a mozgás indítás és leállítás és a program váltás megnehezülése. A Parkinson-kór diagnózisának egyik alappillére.
2.5. Disztónia: Akarattól független izom összehúzódás, amely tartászavart hoz létre (pl. tortikollis, OFF-disztónia: az öregujj dorzalflexiója, stb.), gyakran komoly fájdalommal jár, diszkinézissel ötvöződhet.
2.6. Diszkinézis: akarattól független, ismétlődő, irreguláris izommozgás (pl. a végtagokban korea, a törzsön atetózis formájában, disztóniával ötvöződhet).
2.7. Életminőség: A beteg utóbbi 3 életévére vonatkozóan, a személyére szabott kezelés megítélésére kialakított fogalom. A beteg állapotának önértékelő teszt segítségével való értékelését teszi lehetővé, értékes módon kiterjeszti a célzott anamnézis felvételének értelmét, célszerűen egészíti ki az UPDRS, illetve az MDS-UPDRS skálákat. Hazánkban több teszt is validált, alkalmazható (pl. PDQ-39).
2.8. Ergot derivátum: Növényből kivont dopamin agonista hatású gyógyszerkészítmény. Retroperitoneális, pleuropulmonális és kardiális valvuláris fibrózist okozhat. Alkalmazása során félévenként transztorakális szív ultrahang vizsgálat kötelező.
2.9. Fluktuáció: A betegség súlyosbodása során a korábban egész nap hatásos gyógyszeres kezelés hatása egyenetlenné válik. Az egyik típusa a hatáscsökkenés-dózis lecsengés (Wearing-off, WO) és a rossz mozgásteljesítménnyel járó állapot (OFF), melyhez disztónia kapcsolódhat, a másik a dózis időbeli csúcshatásához kapcsolódó, akarattól független mozgások (csúcsdózis diszkinézia, ON-diszkinézia). A kórlefolyás során a WO és az OFF általában megelőzi a csúcsdózis diszkinézia jelentkezését. A fluktuáció a kétféle állapot egymást követő váltakozását jelenti. A fluktuáció kialakulásában a kezelés kizárólagos szerepe egyértelműen nem bizonyított.
2.10. Freezing: „Lefagyás”. A mozgás, a mozgáskoordináció hirtelen, váratlan zavara, leállása.
2.11. Késői Parkinson-kór/betegség: Késői Parkinson-kórról a motoros komplikációk megjelenése után beszélünk.
2.12. Komorbid betegségek: A Parkinson-kórhoz kapcsolódó bármely betegség. A betegség lefolyása során bármikor fontos ezek felismerése és mérlegelésük a terápiában. Különösen fontos a pszichiátriai betegségek elkülönítése és kezelése.
2.13. Komplex nem-motoros tüneti szindróma: A motoros tüneteket több évvel megelőző tünetegyüttes, amely a betegség megjelenésére utal/prognosztizálja: székrekedés, szaglászavar, hangulati élet elcsendesedése - hangulatzavar, alvászavar, nyálfolyás, vizelettartási zavar, egyoldali vállfájdalom, szürkületi látás problémák.
2.14. Motoros tünetek: A bazális ganglionok működészavara által kiváltott mozgató rendszeri tünetek. Ezek a Brit Agybank kritériumrendszere alapján meghatározott fő mozgás zavar típusok és a hozzájuk kapcsolódó másodlagos mozgatórendszeri tünetek együttesen.
2.15. Nem motoros tünetek: A beteg életminőségét a motoros tüneteknél is markánsabban meghatározó összes eltérés: kognitív, hangulati, magatartási, érzőrendszeri, fájdalmi, autonóm idegrendszeri, gasztrointesztinális jellegű panaszcsoportok és vizsgálható eltérések. Ezek egy része megelőzi a motoros tüneteket. Számuk szaporodik a betegség lefolyása során, és a motoros fluktuációkhoz kapcsolódva még erőteljesebbek lesznek.
2.16. Nyugalmi tremor: A végtagok, az ajak, a nyelv, a szempilla oszcilláló, ritmusos, akarattól független mozgása, amely a testrész akaratlagos innervációtól mentes állapotában észlelhető, és akaratlagos mozgás során megszűnik. A Parkinson-kór diagnózisának másik, lehetséges motoros alappillére. A betegek egy részében mozgásra aktiválódó végtag komponensek lehetnek.
2.17. On-off jelenség: Motoros komplikáció. A gyógyszeres kezelés hatására csökkennek a Parkinson-kór tünetei, azonban a hatóanyag koncentrációja az agyban nem állandó. Amikor a szint alacsony, a tünetek erősebbek (off fázis). Az off és on fázis váltakozása jelenleg együtt jár a Parkinson-kórral, és a hosszú távú levodopa kezelés után az ingadozás kiszámíthatatlanabbá válik.
2.18. Parkinsonizmusok: A Parkinson-kórtól (betegségtől) elkülöníthető, de hasonló tünetekkel rendelkező kórismék.
2.19. Parkinson-kór (PK): A hazai szakmai nyelvhasználat alapján az (Idiopátiás) Parkinson-szindróma, amely az eljárásrendben részletesen leírásra került, amely a leírásra kerülő terápiákkal tünetileg egyértelműen kezelhető (angolszász forrásokban: Parkinson’s Disease).
2.20. Parkinson-kór előrehaladott szakasza: A motoros komplikációk azon szakasza, mely során a beteg életminősége nem tartható fenn a komplex gyógyszeradagolás egyénre szabott módszereivel, a súlyos tünetek és az állapot kifejezett, permanens változékonysága csak speciális kezelési eljárások alkalmazásával biztosítható. Ez a szakasz a beteg haláláig tart. A kezelés indikációja, esetleges leállítása a beteg belegyezése és neurológus által vezetett munkacsoport döntésén alapszik.
2.21. Parkinson-kór korai szakasza: A motoros tünetek megjelenésétől a motoros fluktuációk megjelenéséig (diagnosztikus kritériumok alapján felállított diagnózis).
2.22. Parkinson-kór motoros komplikációk szakasza: A motoros fluktuációk kezdetétől a betegség előrehaladott fázisán át a beteg haláláig tartó szakasz.
2.23. Parkinson-szindrómák (PSZ): Ezen betegségekben a Parkinson-kórra jellemző neurológiai gócjelekhez (parkinzonizmus tünetei) egyéb, a beteg sorsát döntően meghatározó neurológiai eltérések kapcsolódnak a betegség kezdetétől, máskor későbbi szakaszában. Ezen betegségek patomechanizmusa egyes esetekben teljesen eltér a Parkinson-kórban ismertektől. Ezen betegségek tünetei kismértékben vagy nem reagálnak a klasszikus dopaminerg terápiára.
2.24. RBD (REM alvás magatartás zavar): Az alvás REM fázisát nem a szokásos tónustalanság jellemzi, hanem folyamatos mozgások, testhelyzetváltozások, hangadás, kiabálás, ágyról való leesés, ágynemű összegyűrése és az ezzel járó kellemetlen tartalmú álmok.
2.25. Rigor: Az izomzat nyugalomban is fennálló, sokszor fájdalmas feszülése, amely egyaránt érinti a végtagok agonista és antagonista izmait. A Parkinson-kór diagnózisának másik alappillére lehet.
2.26. Tremor: Nyugalmi remegés. A Parkinson-kór motoros alaptünete.
2.27. Wearing-off állapot: A dopaminerg gyógyszerhatás (levodopa, dopamin agonista) visszatérő, gyógyszerbevételektől függő formája és a hatástalanság megjelenését jelenti: a már hatékonyan kezelt motoros és nem-motoros tünetek igen kifejezetten visszatérnek. Hatáscsökkenés esetén egyenletesen, míg dózisvégi csökkenés esetén a következő bevett gyógyszer adag hatása jelentkezéséig. Különleges OFF-állapotok is vannak: a hatáskésés (Delayed-ON): a „szokásos” idő elmúltával nem jelentkezik a hatás, csak később; hatás elmaradás (No-ON): a gyógyszerbevétel ellenére nincs hatás.
2.28. „Red Flag”: Olyan panasz és neuropsychiátriai jelenség, gócjel, amely a betegség korai szakaszában jelzi a vizsgálónak, hogy Parkinson-szindróma valószínű és nem Parkinson-kór.
3. Kórkép leírása
3.1. A Parkinson-kór gyakori, progresszív neurodegeneratív betegség, amelyben az idegrendszerben a substantia nigra dopaminerg neuronjainak degenerációja miatt a dopamin-szint leesik. A dopamin a szervezetben a neuronok közötti ingerület-átvitelért felelős, így a szint csökkenése az idegsejtek közötti kommunikációt akadályozza.
3.2. A Parkinson-kór a mozgászavarokhoz tartozó neuropsychiátriai betegség. A betegség diagnózisa ma is klinikai és két ún. pillértüneten nyugszik: az egyik mindenképpen a bradykiézia/hypokinézia (a mozgás program lassúsága), míg a másik pillértünet lehet a rigor (merevség) vagy a nyugalmi tremor (végtag, ajak, pilla akarattól független, azaz nyugalmi ritmikus mozgása), vagy mind a kettő. A negyedik főtünet a betegség előrehaladott szakaszában jelentkezik, ez a tartási instabilitás. Előfordulhat a betegség kezdetén tremor domináns klinikai forma, ennek diagnózisa nehezebb.
3.3. Parkinson-kórban a motoros tüneteken kívül nagy jelentőségük van a nem-motoros tüneteknek is: pszichológiai problémák, demencia, a későbbiekben autonóm zavarok. A betegség előrehaladott fázisban komoly fogyatékossághoz, rokkantsághoz vezet, nagymértékű életminőség-csökkenést okoz.
3.4. A Parkinson-kór prevalenciája 200-400 fő/100 000 lakosra, Magyarországon a betegszám megközelítőleg 20 000 fő, a betegek 50-70%-a áll kezelés alatt. Jelenleg az évi incidencia 8-10/100 000 lakos, de az arány folyamatosan növekszik.
4. Finanszírozás rendje, finanszírozási algoritmus
5. A Parkinson betegség ellátására vonatkozó emelt, indikációhoz kötött támogatás:
5.1. EÜ90 6/a. Támogatott indikációk:
Parkinson-kór és Parkinson-szindróma (másodlagos parkinsonismus) kezelésére – a finanszírozási eljárásrendekről szóló miniszteri rendeletben meghatározott finanszírozási eljárásrend alapján
5.1.1. amantadine
5.1.2. biperiden
5.1.3. levodopa, benserazide hydrochloride
5.1.4. procyclidine
5.1.5. selegiline
5.2. EÜ90 6/b. Támogatott indikációk:
Parkinson-kór esetén, az alkalmazási előírásban szereplő monoterápiában, L-DOPA és selegilinnel, illetve amantadinnal való kombinált kezelésben kiegészítő kezelésként is, ha súlyos motoros fluktuáció jelentkezik – a finanszírozási eljárásrendekről szóló miniszteri rendeletben meghatározott finanszírozási eljárásrend alapján
5.2.1. pramipexole
5.2.2. rasagiline
5.2.3. ropinirole
5.2.4. rotigotine
5.3. EÜ90 6/c. Támogatott indikációk:
Parkinson-kórban kialakuló motoros fluktuáció minden esetében – a finanszírozási eljárásrendekről szóló miniszteri rendeletben meghatározott finanszírozási eljárásrend alapján
5.3.1. entacapone
5.3.2. levodopa, carbidopa, entacapone
6. Adminisztratív ellenőrzési pontok (folyamatba épített ellenőrzés)
6.1. Kompetencia szint: kijelölt intézmény, szakorvosi kompetencia ellenőrzése
6.2. Betegadatok (online TAJ ellenőrzés)
6.3. Jogszabályban rögzített indikációs terület BNO ellenőrzése
7. Szakmai ellenőrzési pontok
7.1. A klinikai diagnózis felülvizsgálata rendszeres időközönként, fél-egyévente történik.
7.2. A diagnózis klinikai szempontrendszer szerint történik, MRI, PET-CT és CT Parkinson-szindróma differenciál diagnózisában nem kötelező, de indokolt lehet, agyi SPECT csak indokolt esetben (fent meghatározott) végzendő.
7.3. A gyógyszeres kezelés akkor kezdődhet, ha a klinikai diagnózis megszületett. A Parkinsonos tünetek egységes rendszer alapján értékelhetőek. Az UPDRS (Unified Parkinson’s Disease Rating Scale) vagy az ebből továbbfejlesztett MDS-UPDRS (Movement Disorders Society Unified Parkinson’s Disease Rating Scale) skála lehetőséget ad erre.
7.4. Anticholinerg és amantadin korai Parkinson-kórban első választású terápiaként nem alkalmazható, kivéve, ha a beteg egyéb, gyógyszer-indukálta másodlagos parkinsonismusban szenved. Ekkor anticholinerg szer adható. COMT gátló csak a fluktuációk kezdetétől adható.
7.5. Neuroprotektív céllal csak klinikai vizsgálat keretében kezelhetők a betegek.
7.6. A motoros komplikációk klinikai megállapítása után (Parkinson skálák) a beteg adjuváns terápiában részesül. Az adjuváns terápia a motoros komplikációk jellegétől és mértékétől függ.
7.7. Az ún. előrehaladott kezelési lehetőségek, mint műtéti beavatkozás csak speciális (fent meghatározott) esetekben indokolt.
7.8. Minden beteg számára hozzáférhető kell, hogy legyen a fizioterápiás kezelés, a pszichológiai és szociális kezelés/gondozás.
7.9. A Parkinson-kór diagnózisának felállításától kezdve a betegek kezelésben részesülnek a nem-motoros tünetek kontrollálására.
8. A finanszírozási eljárásrend alkalmazásának hatását mérő minőségi indikátorok
8.1. A területre fordított közkiadások alakulása.
8.2. A helyes, finanszírozott algoritmus szerint kezelt betegek aránya.
9. A finanszírozás szempontjából lényeges finanszírozási kódok
9.1. A releváns BNO kódok
|
A |
B |
1 |
BNO |
BNO megnevezés |
2 |
G20H0 |
Parkinson-kór |
3 |
G2110 |
Egyéb, gyógyszer-indukálta másodlagos parkinsonismus |
4 |
G2120 |
Más külső tényezők okozta másodlagos parkinsonismus |
5 |
G2130 |
Agyvelőgyulladás utáni parkinsonismus |
6 |
G2180 |
Egyéb másodlagos parkinsonismus |
7 |
G2190 |
Másodlagos parkinsonismus k.m.n. |
8 |
Y4670 |
Antiparkinson gyógyszerek |
9.2. Releváns ATC kódok
|
A |
B |
1 |
ATC |
ATC megnevezése |
2 |
N04* |
Anti-parkinson gyógyszerek |
3 |
N04A* |
Anticholinergek |
4 |
N04AA |
Tercier aminok |
5 |
N04B* |
Dopaminergek |
6 |
N04BA |
Dopa és dopa derivátumok |
7 |
N04BB |
Adamantane derivátumok |
8 |
N04BC |
Dopamin agonisták |
9 |
N04BD |
MAO-B gátlók |
10 |
N04BX |
Egyéb dopaminergek (COMT-gátlók) |
9.3. Finanszírozott hatóanyagok Magyarországon
|
A |
B |
1 |
ATC |
Hatóanyag |
2 |
N04AA02 |
biperiden |
3 |
N04AA04 |
prociklidin |
4 |
N04BA02 |
levodopa és decarboxylase gátló |
5 |
N04BA03 |
levodopa, decarboxylase gátló és comt gátló |
6 |
N04BB01 |
amantadin |
7 |
N04BC04 |
ropinirol |
8 |
N04BC05 |
pramipexol |
9 |
N04BC09 |
rotigotine |
10 |
N04BD01 |
selegilin |
11 |
N04BD02 |
rasagiline |
12 |
N04BX02 |
entacapone |
10. Rövidítések
ATC Gyógyszerek anatómiai, terápiás, illetve kémiai osztályozása
BNO Betegségek nemzetközi osztályozása
”
11. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
A hepatitis B vírus okozta krónikus májgyulladás diagnosztikájának és terápiájának finanszírozási eljárásrendje
1. Az eljárásrend tárgyát képező betegség, betegcsoport megnevezése
Idült vírusos B-típusú hepatitis d-ágenssel (B1800)
Idült vírusos B-típusú hepatitis d-ágens nélkül (B1810)
2. Kórkép leírása
2.1. Járványtan
2.1.1. Kórokozója a hepatitis B vírus, a Hepadnaviridae család tagja, mely egy DNS vírus. A fertőzést követően az esetek túlnyomó többségében (70%) tünetmentes infekció zajlik, tünetek csupán 30%-ban alakulnak ki. A fertőzött felnőttek 5-10%-ában jön létre chronicus fertőzés. Hazánkban kb. 7-15 000 beteg szorulhat ténylegesen kezelésre.
2.1.2. A kórkép jelentőségét az adja, hogy a vírus általában parenterálisan terjed, fertőzött vér és vérkészítmények útján. A donorvér rutinszerű szűrése jelentősen csökkentette a fertőzések átvitelét, de a kábítószer élvezők által közösen használt injekciós tűk még mindig komoly veszélyt jelentenek. A fertőzés kockázata nagyobb haemodyalizált betegeken, onkológiai betegeken és vérrel érintkezésbe kerülő kórházi dolgozókon. A fertőzés a parenterális úton kívül más módon is terjedhet, hetero- és homoszexuális érintkezéssel, valamint zárt intézményekben (pl. börtönök). A fertőzés reservoirjai világszerte az idült HBV hordozók. A fertőzés prevalenciája földrajzi és más tényezőktől függően jelentősen eltérő lehet (0,5%-10%), Távol-Keleten akár a 10%-ot is meghaladja. A vertikális transzmisszió különösen ezeken a vidékeken fordul elő.
2.2. Diagnózis felállítása
A diagnosztikában az anamnézis felvétel, valamint a fizikális vizsgálat mellett nagy jelentősége van a labor diagnosztikának. A beteg általános tünetekkel keresi fel háziorvosát: fáradékonyság, gyengeség, émelygés, hányinger, láz, urticaria-szerű kiütések, ízületi fájdalmak, jobb bordaív alatti nyomás, feszülés, sötét vizelet. A labor diagnosztika magában foglalja a hagyományos „máj-panel” vizsgálatokat, a háromféle antigén-antitest rendszer (Hbe, Hbs, Hbc) kimutatását, valamint magának a vírusnak a jelenlétét, illetve a vírus kópiaszám kimutatását is. Ez utóbbi igen érzékeny PCR technikával történik. A vírus kópiaszámának az ismerete alapvető a terápia eldöntése, valamint a beteg monitorozása szempontjából.
2.3. Klinikai lefolyás
A betegnél a tünetek jelentkezését követően icterus alakul ki. Az esetek túlnyomó többségében a vírus eliminálódik a májból kiterjedt májsejt destrukció nélkül is. A HbsAg és a HbeAg eltűnését követően magastiterű antitest szintek detektálhatók, de a HBV DNS alacsony szinten még hosszú ideig kimutatható. Persistáló vírusinfekció esetén a vírusprodukció folytatódik, gyakran életfogytiglan, de krónikus fertőzés esetén a viraemia mértéke alacsonyabb szinten marad. Szintje az idő múlásával fokozatosan csökken és seroconversio is bekövetkezhet. Ennek éves gyakoriságát az érintett populációban kb. 5-10%-ra becsülik. Tartós HBV hordozás a primer hepatocellularis carcinoma (HCC) kialakulásának gyakoriságát a százszorosára növeli az átlagos populációhoz képest. A Hbe Ag pozitív csoportban a HCC kialakulásának gyakorisága még nagyobb.
3. Terápia
A kezelés legfontosabb célja a viraemia csökkentése, illetve megszüntetése, a vírusreplikáció gátlása és a májkárosodás javítása, illetve gyógyítása. A vírus folyamatos jelenléte esetén sokkal nagyobb a kockázata a chronicus hepatitis, cirrhosis, illetve a hepatocellularis carcinoma kialakulásának. Leginkább veszélyeztetettek a HbeAg pozitív, valamint a HbeAg negatív, de magas vírus titerű betegek. A terápia eredményességét a HbeAg eliminálása és a keringésben kimutatható vírusok számának csökkenése, illetve seroconversio kialakulás (anti-Hbe antitestek kialakulása) jelzi.
4. Az ellátás igénybevételének finanszírozott szakmai rendje, finanszírozási algoritmusa
4.1. A finanszírozási algoritmus részletezése
4.1.1. A diagnózis felállítása (1)
4.1.1.1. Anamnézis felvétele.
4.1.1.2. Fizikális vizsgálat.
4.1.1.3. Labordiagnosztika.
4.1.1.4. A laborvizsgálatok eredményei alapján kerül a beteg terápiára vagy megfigyelésre.
4.1.1.5. Az alapellátás feladata a májbetegség felismerése és a HBV markerek (HBsAg, anti-HBs és anti-HBc) vizsgálata (utóbbiak elvégzése májkárosodás észlelésekor vagy rizikócsoportokban célszerű). A betegek szakellátása hepatológiai centrumokban összpontosul.
4.1.1.6. Klinikai vizsgálatok alapján krónikus B hepatitisben a GPT/ALT normál értékének felső határa férfiaknál 30 U/l, nőknél 19 U/l. Ennek a határértéknek a figyelembe vétele követendő a terápiás döntésnél. A májbetegség súlyosságának a felméréséhez egyéb biokémiai vizsgálatok (AST/GOT, GGT, ALP, se. albumin, bilirubin), prothrombin, teljes vérkép és hasi UH szükséges.
4.1.2. A kezelést eldöntő vizsgálatok:
4.1.2.1. HBV-DNS mennyiségi PCR.
4.1.2.2. HBeAg, anti-HDV pozitivitás esetén antiIgM-antiHDV, illetve HDV Ag.
4.1.2.3. Májbiopsia HAI>1, illetve stage>1, illetve tranziens elasztográfia (FibroScan) liver stiffness (LS)≥6,0 KPa.
4.1.2.4. Cirrhosis bármely stádiuma: HBV-DNS pozitivitás esetén a vírus titertől és a GPT/ALT-től függetlenül kezelendő.
4.1.2.5. Immunsszupprimált, szervtranszplantált beteg (lásd speciális betegségcsoportok címszó alatt).
4.1.2.6. Biológiai terápia (különösen rituximab) előtt és csontvelő transzplantált betegben, ha a beteg antiHBc pozitív, akkor HBV DNS javasolt és pozitív lelet esetén kezelendő (lásd speciális betegcsoportok címszó alatt).
4.1.2.7. Cirrhosis Child A stádiuma: HDV Ag vagy anti-IgM-antiHDV pozitivitás esetén a GPT/ALT-től függetlenül HBV-DNS negativitás esetén is IFN-nal kezelendő.
Megjegyzés: IgM-antiHDV pozitivitás HBV-DNS negativitás esetén is a kezelés indikációja!
4.1.3. Differenciáldiagnosztika: HBeAg, anti-HBe; totál anti-HD; anti-HCV, anti-HIV 1;2, és a társbetegségek (autoimmun, alkoholos, metabolikus májbetegség steatosissal) vizsgálata. Ezek eredménye a kezelési tervet befolyásolhatja.
4.1.4. A kezelés feltételei
4.1.4.1. Kontraindikácó hiánya.
4.1.4.2. A beteg dokumentált beleegyező nyilatkozata. A kezelés megkezdése előtt a beteget részletesen tájékoztatni szükséges.
4.1.5. Terápia
(2): HBV-DNS mennyiségi real-time PCR meghatározása az egészségügyi szakellátás társadalombiztosítási finanszírozásának egyes kérdéseiről szóló 9/1993. (IV. 2.) NM rendelet mellékletében nevesített, akkreditált molekuláris diagnosztikai laboratóriumban végezhető, CE jelzésű teszttel, IU/ml egységben kifejezve. Ugyanazt a tesztet kell a diagnózis felállításához és a terápia követéséhez használni, hogy értékelhető és összehasonlítható legyen a kezelés hatékonysága. (HBV DNS kvalitatív meghatározásának nincs indikációja!) (3): Hat hónapon belül 3 alkalommal a határértéket meghaladó GPT/ALT érték vagy ha a fertőzöttség igazolhatóan 6 hónapnál régebben fennáll, akkor a kezelés megkezdése előtti egyetlen határértéket meghaladó GPT/ALT érték, illetve szövettanilag igazolt krónikus hepatitis, hisztológiai aktivitással (HAI>1), illetve fibrosissal (F>1), illetve tranziens elasztográfia (FibroScan) liver stiffness (LS)≥ 6,0 KPa. Konzekvensen emelkedett GPT/ALT és HBeAg pozitív esetben 20 000 IU/ml, anti-HBe pozitív esetben 2 000 IU/ml feletti HBV-DNS titer esetén a májbiopsiától és a non-invazív fibrosis meghatározástól el lehet tekinteni.
GPT/ALT emelkedett értéke az aktív hepatitis fennállását támogatja, de a fertőzés immuntoleráns fázisában perzisztálóan normál az értéke, és a HBeAg negatív betegek egy részében is intermittáló a szintje. Hosszú távú követés alatti változása a terápiás protokoll megtervezésében döntő fontosságú.
4.1.6. A kezelést meghatározó eredmények:
(3): HBeAg pozitív, HBV-DNS 20 000 IU/ml (2×104 IU/ml = 105 copia/ml) felett, GPT/ALT emelkedett, vagy
(3): HBeAg negatív, HBV-DNS 2 000 IU/ml (2×103 IU/ml) felett, GPT/ALT emelkedett
4.1.6.1. ha a GPT/ALT normális: tranziens elasztográfia (Fibroscan)- liver stiffness (LS)≥ 6,0 KPa, (6) illetve májbiopsia HAI>1, illetve stage>1 (7), valamint
4.1.6.2. ha a HBV-DNS fentinél alacsonyabb, de GPT/ALT emelkedett: tranziens elasztográfia (Fibroscan)- liver stiffness (LS)≥ 6,0 KPa, (8) vagy májbiopsia HAI>1, illetve stage>1 (9), a kezelés megkezdése indokolt (4).
4.1.6.3. Ha a HBV-DNS a fentieknél alacsonyabb és a GPT/ALT normális: nem kezelendő, obszerválandó, (10) kivételeket lásd speciális betegcsoportok címszó alatt.
4.1.7. Szupportív terápia: diétás étrend, alkohol megvonása, hepatotoxikus szerek kerülése.
A kezelés előtt vagy alatt hepatitis A ellen vakcináció javasolt.
4.1.8. INF készítmények (5)
4.1.8.1. Peg-INF készítmények: PEGASYS 135, 180 MIKROGRAMM (PegINF-alfa 2a)
4.1.8.1.1. Adag: 180 μg/hét monoterápia.
4.1.8.1.2. A kezelés időtartama általában 1 év.
4.1.8.1.3. IgM-antiHDV pozitív esetekben a kezelés időtartama másfél év.
4.1.8.1.4. Beszűkült veseműködés esetén a peginterferon alfa–2a adagja heti 135 μg.
4.1.8.1.5. A választható gyógyszerek rendelésének egyes szempontjait és a kontraindikációkat részletesen az alkalmazási előiratok ismertetik, amelyek minden esetben kiegészítik a jelen eljárásrendben foglaltakat.
4.1.8.2. Standard INF-k
Alternatíva 18 év alatti életkorban, alacsony fvs, illetve thrombocyta szám mellett, anamnézisben cytopenia esetén hetente 3×5-6 ME/m2 (9-10 ME) standard INFalfa-2a vagy alfa-2b.
4.1.8.3. PEG-IFN kezelés során a kezelés 24. hetében, a kezelés végén, a kezelés befejezése utáni 24. héten, valamint a kezelés alatt jelentkező GPT/ALT emelkedés esetén HBV-DNS vizsgálat (real-time mennyiségi PCR) ajánlott.
4.1.8.4. A PCR vizsgálat mellett a HBs antigén titer monitorozása javasolt.
4.1.8.5. HBe pozitív esetekben a kezelés 24. és 48. hetében HBe, illetve anti-HBe meghatározás.
4.1.9. A terápia eredményességének megítélése PEG-INF kezelés során:
4.1.9.1. Részleges virológiai válasz: HBV DNS titer csökkenés > 1 log10, de > 2 000 IU/ml a kezelés 24. hetében.
4.1.9.2. Áttörés (breakthrough): Viraemia újbóli megjelenése vagy a vírustiter legalább 1 log10 emelkedése (NA-ra váltás javasolt).
4.1.10. Nukleozid analógok (NA)
4.1.10.1. Az NA készítmények rendelésének feltételei
4.1.10.1.1. 12 hónapos INF kezelésre nem reagáló beteg.
4.1.10.1.2. INF kezelésre reagáló, de relapsust mutató beteg.
4.1.10.1.3. HBeAg negatív, de HBV-DNS pozitív, anti-HBc-IgM negatív krónikus hepatitis (pre-core mutáns).
4.1.10.1.4. Biológiai terápia előtt és csontvelő transzplantált betegben.
4.1.10.1.5. Önállóan első szerként vagy gyógyszer-rezisztencia kialakulásakor második készítményként, utóbbi esetben kombinációban is.
4.1.10.1.6. Szervtranszplantált HBsAg, illetve HBV-DNS pozitív beteg.
4.1.10.1.7. HBV-fertőzött transplantált beteg profilaktikus kezelése.
4.1.10.1.8. Immunszuppresszív vagy kemoterápiában részesülő HBsAg, illetve HBV-DNS pozitív beteg.
4.1.10.1.9. HBV okozta cirrhosis bármely stádiuma.
4.1.10.1.10. INF bármely okból ellenjavallt.
4.1.10.1.11. IgM-antiHDV negatív.
4.1.10.2. Az NA kezelés megkezdése után 12 héttel és 24 héttel, majd félévenként, valamint a kezelés alatt jelentkező GPT/ALT emelkedés esetén HBV-DNS vizsgálat (real-time mennyiségi PCR) ajánlott.
4.1.10.2.1. Cirrhosis betegekben szóba jön a háromhavonta végzett kontroll.
4.1.10.2.2. Viraemia újbóli megjelenése vagy a titer 1 log emelkedése, illetve jelentős GPT/ALT emelkedés gyógyszer rezisztens mutációra utal. Ilyenkor rezisztencia meghatározás ajánlott. Mutáns megjelenésekor gyógyszerváltás indokolt azon esetekben is, ha a mutáció direkt kimutatására nincs mód.
4.1.10.2.3. HBe pozitív esetekben a kezelés alatt félévente HBe, illetve anti-HBe meghatározás javasolt.
4.1.10.3. A terápia eredményességének megítélése NA kezelés során:
4.1.10.3.1. Primer nonresponder: A kiindulási vírustiter csökkenése a 12. hétre <1 log10. (NA váltás vagy NA kombináció adása javasolt).
4.1.10.3.2. Részleges virológiai válasz: Detektálható HBV DNS szint a kezelés alatt. (NA váltás vagy NA kombináció adása javasolt).
4.1.10.3.3. Áttörés (breakthrough): Viraemia újbóli megjelenése vagy a vírustiter legalább 1 log10 emelkedése. (NA váltás vagy NA kombináció adása javasolt).
4.1.11. Az NA készítmények
4.1.11.1. Lamivudin
4.1.11.1.1. Alkalmazása során igen nagy arányban fordul elő rezisztencia, különösen, ha monoterápiában alkalmazzák. Emiatt a lamivudin csak olyan esetekben indítható, amennyiben más kezelési mód nem áll rendelkezésre vagy ellenjavallt.
4.1.11.2. Kezelési mód:
4.1.11.2.1. HBe-Ag pozitív és negatív krónikus B hepatitis: napi 1×100 mg.
4.1.11.2.2. Beszűkült veseműködés esetén a GFR-től függően dóziscsökkentés vagy váltás (entecavir önmagában) javasolt.
4.1.11.2.3. HBV DNS titer emelkedése + GPT/ALT emelkedése esetén hatékony másik nukleoz(t)id készítményre (adefovir dipivoxil hozzáadása vagy entecavir, tenofovir önmagában) váltás szükséges.
4.1.11.3. A kezelés időtartama:
4.1.11.3.1. HBe-Ag pozitív esetben az anti-HBe szerokonverzió után minimum 6 hónapig.
4.1.11.3.2. HBe-Ag negatív esetben a HBsAg/HBV DNS eltűnése, illetve az anti-HBs megjelenése után minimum 6 hónapig.
4.1.11.3.3. A már lamivudin kezelésben részesülő (nem dekompenzált májbetegségben szenvedő) betegek esetében az NA váltás, illetve kombináció – igazolt lamivudin rezisztencia esetén túl – azokban az esetekben indokolt, ha a lamivudin kezelés effektusa nem megfelelő, azaz:
− a lamivudin kezelés alatt korábban negatív HBV DNS (<12 IU/ml) pozitívvá válik, vagy
− a lamivudin kezelés alatt a HBV DNS titer 1 log10 (egy nagyságrenddel) nő, vagy
− a lamivudin kezelés során a HBV DNS titer > 2 000 IU/ml, vagy
− a lamivudin kezelés alatt a HBV DNS nem negatív (> 12 IU/ml) és a GPT/ALT kóros.
4.1.12. Adefovir dipivoxil
4.1.12.1. A tenofovirnál kevésbé hatékony készítmény, rezisztencia kialakulása viszont gyakoribb. Lamivudin rezisztencia esetén lamivudinnal kombinációban ajánlott.
4.1.12.2. Kezelési mód:
4.1.12.2.1. 1×10 mg naponta.
4.1.12.2.2. Beszűkült vesefunkciók esetén a dózis a gyógyszer alkalmazási előiratában megadott séma szerint csökkentendő. (Adefovir rezisztencia esetén tenofovirra váltás javasolt a mutációtól függően kombinációban lamivudinnal, entecavirral).
4.1.13. Entecavir
4.1.13.1. Az egyik leghatásosabb NA, a rezisztencia kialakulásának esélye csekély.
4.1.13.2. Kezelési mód:
4.1.13.2.1. Nukleozid naiv betegnek 1×0,5 mg naponta.
4.1.13.2.2. Lamivudin rezisztens vírus: napi 1×1,0 mg.
4.1.13.2.3. Beszűkült vesefunkciók esetén elsősorban javasolt NA, szükség esetén a gyógyszer alkalmazási előiratában megadott séma szerint csökkentett dózisban.
4.1.14. Tenofovir
4.1.14.1. Az egyik leghatásosabb NA, rezisztencia kialakulásával ritkán kell számolni.
4.1.14.2. Kezelési mód:
4.1.14.2.1. Napi adagja 1×245 mg.
4.1.14.2.2. Lamivudin és adefovir rezisztens vírus esetén is ajánlott.
4.1.15. A kezelés befejezése:
4.1.15.1. A kezelés befejezésekor vérkép, májfunkciók, HBV-DNS vizsgálat szükséges.
4.1.15.2. Emellett:
4.1.15.2.1. korábban HBeAg pozitív esetben a HBeAg/anti-HBe vizsgálat megismétlése javasolt,
4.1.15.2.2. korábban HBeAg negatív esetben a HBsAg/anti-HBs vizsgálat megismétlése javasolt,
4.1.15.2.3. hat hónappal később vérkép, májfunkciók, HBV DNS, HBsAg vizsgálat szükséges.
4.1.16. Speciális betegcsoportok:
4.1.16.1. Kompenzált cirrhosis
Alpha-INF (standard vagy pegilált alpha 2a) vagy NA adható. Utóbbiak közül különösen az entecavir vagy a tenofovir ajánlott, az igen ritkán kialakuló rezisztencia miatt. Az NA kezelés a beteg élete végéig folytatandó.
4.1.16.2. Dekompenzált cirrhosis
Hatásos NA-t kell adni, mely esetében kicsi a rezisztencia kialakulásának az esélye (entecavir vagy tenofovir). (11) Az NA kezelés a beteg élete végéig folytatandó.
4.1.16.3. Májtranszplantált betegek
A transzplantáció előtt minden HBsAg pozitív betegnek olyan, hatásos NA-t kell adni, amely esetében kicsi a rezisztencia kialakulásának esélye (entecavir, tenofovir). A kezelés a beteg élete végéig folytatandó.
A gyógyszerkészítmények alkalmazásánál figyelemmel kell lenni az egyes készítmények Alkalmazási előírásában foglaltakra.
HBsAg negatív/ anti-HBc pozitív szerostátuszú májdonor recipiensei
A javasolt profilaxis a transzplantáció után:
|
A |
B |
1 |
Recipiens |
Profilaxis |
2 |
HBsAg poz |
HBIG + entecavir |
3 |
anti-HBs poz és anti-HBc poz |
nem szükséges |
4 |
anti-HBs neg és anti-HBc poz |
entecavir |
5 |
anti-HBs poz és anti-HBc neg (sikeresen oltott) |
entecavir |
6 |
anti-HBs neg és anti-HBc neg (naiv) |
entecavir |
HBIG: HBV immunglobulin
HBsAg negatív/anti-HBc pozitív donorból származó vesegraft recipiensei
HBsAg negatív/anti-HBc pozitív donorból HBsAg negatív/anti-HBc pozitív, valamint a HBsAg negatív/anti-HBc negatív recipiensbe végezhető veseátültetés, amennyiben mind a donor, mind a recipines anti-HBs titere nagyobb, mint 100 mIU/ml. Ezekben az esetekben a recipiens legalább 6 hónapos NA kezelése szükséges. Az entecavir alkalmazása indokolt.
Rendszeres HBV szerológiai és PCR vizsgálata javasolt:
HBV szerológia a transzplantáció után 3, majd 6 hónappal, ezt követően félévente, a HBV DNS PCR a transzplantáció után 6 hónappal, majd évente, illetve a HBV fertőzés reaktiválódásának gyanúja esetén soron kívül is.
4.1.16.4. HBV-HIV koinfekció
Az indikáció megegyezik a HIV negatív betegek esetében leírtakkal. Az esetek többségében a HIV és a HBV egyidejű, de novo kezelése javasolt: tenofovir és emtricitabin, továbbá egy harmadik, HIV ellen hatásos készítmény adásával.
Ha a HIV fertőzés kezelése előtt alkalmazunk HBV elleni kezelést, a HIV-re bizonyított hatással nem rendelkező adefovir vagy telbivudin választandó.
A HIV és HBV elleni hatással is rendelkező lamivudin, entecavir és tenofovir monoterápiában ellenjavallt ezekben az esetekben.
4.1.16.5. HBV-HCV koinfekció
HBV DNS általában negatív vagy alacsony titerű. A kezelés megegyezik a krónikus C hepatitis (monoinfekció) esetén leírtakkal, a várható SVR arány is hasonló. A HCV fertőzés sikeres kezelése után számolni kell a HBV reaktiválódásával, ezért ilyenkor NA adása javasolható.
4.1.16.6. Fulmináns vagy fenyegető fulmináns akut B hepatitis
NA alkalmazása előnyös lehet. A krónikus B hepatitishez hasonlóan a hatásosabb készítmények (entecavir, tenofovir) preferálandók, melyek esetében a rezisztencia kialakulásának esélye csekély. A kezelés optimális időtartama nem ismert, de a HBsAg – anti-HBs szerokonverzió után még legalább 3 hónapig, ennek hiányában a HBe – anti-HBe szerokonverzió után még legalább 6 hónapig javasolt a terápia folytatása.
4.1.16.7. Gyermekek
Csak a hagyományos alphaINF, a lamivudin és az adefovir hatásossága és biztonságossága bizonyított.
4.1.16.8. Egészségügyi dolgozók
HBsAg pozitivitás és HBV DNS>2 000 IU/ml esetén Peg-INFalfa 2a vagy olyan hatásos NA adása javasolt, melyek esetében a rezisztencia kialakulásának esélye csekély (entecavir vagy tenofovir).
4.1.16.9. Terhesség
A lamivudin, az adefovir és az entecavir az FDA osztályozása szerint C kategóriájú készítmények, a tenofovir a B kategóriába tartozik. Szülés után a HBsAg pozitív nők szoros obszervációja indokolt az akut exacerbáció kockázata miatt.
4.1.16.10. Kemoterápia, immunszuppresszív vagy biológiai kezelésben részesülő betegek
Minden fenti kezelésre szoruló beteg esetében el kell végezni a HBsAg és az anti-HBc meghatározását. Ezek pozitivitása esetén hepatologiai konzílium javasolt.
A szeronegatív betegeket aktív immunizációban kell részesíteni. A HBsAg pozitív betegeknek a HBV DNS titertől függetlenül a tervezett kezelés megkezdése előtt el kell kezdeni az NA adását. Entecavir vagy tenofovir adása javasolt.
Az NA kezelést a kemo-, biológiai vagy immunszuppresszív terápia befejezése után még egy évig kell folytatni. Anti-HBc pozitivitás esetén HBV DNS meghatározás szükséges, pozitivitás esetén NA kezelés indokolt.
Anti-HBc pozitív, de HBsAg és HBV DNS negatív betegek esetében szoros obszerváció szükséges: GPT/ALT és HBV DNS monitorozás, reaktiváció esetén NA-t kell adni.
4.1.16.11. Dializált és veseátültetés után levő betegek
NA kezelés indokolt. A veseátültetésen átesett betegek esetében az optimális NA az entecavir.
4.1.16.12. Extrahepatikus manifesztációk
Az antivirális kezelés javasolt (INF vagy NA). Az indikáció és a kezelés módja megegyezik a korábban leírtakkal. Speciális esetekben az NA kezelés kiegészítése plasmapheresissel növelheti a hatékonyságot.
5. A finanszírozás szakmai ellenőrzésének alapját képező ellenőrzési sarokpontok
5.1. A kezelés megkezdése előtti diagnosztikus vizsgálatokat elvégezték és megfelelően dokumentálták?
5.2. A mennyiségi PCR vizsgálatot minden (várhatóan terápiára kerülő) betegnél elvégezték?
5.3. A terápia előtt a betegeket teljes körűen tájékoztatták a kezelés várható kimeneteléről, valamint az esetleges mellékhatásokról?
5.4. A gyógyszerválasztás orvosszakmailag indokolt, a finanszírozási eljárásrendnek megfelelően történt?
5.5. A gyógyszerváltás ténye orvosszakmailag megfelelően alátámasztott és dokumentált?
5.6. A kezelés során szükséges kontroll vizsgálatokat elvégezték és ezek eredményei megfelelően dokumentáltak?
6. A finanszírozási eljárásrend alkalmazásának hatását mérő minőségi indikátorok
6.1. A területre fordított közkiadások alakulása.
6.2. A helyes, finanszírozott algoritmus szerint kezelt betegek aránya.
7. A finanszírozás szempontjából lényeges kódok
7.1. A releváns BNO kódok
|
A |
B |
1 |
BNO |
BNO megnevezés |
2 |
B1800 |
Idült vírusos B-típusú hepatitis d-ágenssel |
3 |
B1810 |
Idült vírusos B-típusú hepatitis d-ágens nélkül |
7.2. A releváns OENO kódok
|
A |
B |
1 |
OENO |
OENO megnevezés |
2 |
11041 |
Vizsgálat |
3 |
88460 |
Vérvétel |
4 |
99910 |
Kiegészítő pont veszélyeztető beteg ellátásáért |
5 |
28014 |
Vérkép automatával IV. |
6 |
24600 |
Aszpartát-amino-transzferáz (ASAT, GOT) meghatározása |
7 |
24610 |
Alanin-amino-transzferáz (ALAT, SGPT) meghatározása |
8 |
24640 |
Gamma-glutamil-transzferáz meghatározása |
9 |
24720 |
Alkalikus foszfatáz meghatározása |
10 |
24741 |
Pszeudo-kolineszteráz meghatározása |
11 |
21020 |
Összfehérje meghatározása szérumban |
12 |
21040 |
Albumin meghatározása szérumban, festékkötő módszerrel |
13 |
21310 |
Glükóz meghatározása |
14 |
21420 |
Összkoleszterin meghatározása |
15 |
21411 |
Trigliceridek meghatározása |
16 |
21150 |
Összes bilirubin meghatározása szérumban |
17 |
21151 |
Konjugált bilirubin meghatározása szérumban |
18 |
28620 |
Prothrombin meghatározása |
19 |
21120 |
Karbamid meghatározása szérumban |
20 |
21140 |
Kreatin meghatározása |
21 |
2627T |
Hepatitis C vírus AT kimutatása |
22 |
2639A |
HBsAg AG kimutatása |
23 |
2639B |
HBsAg konfirmációja |
24 |
2639E |
HBeAg AG kimutatása |
25 |
2627R |
Anti-HBc AT kimutatása |
26 |
2627S |
Anti-Hbe AT kimutatása |
27 |
24060 |
TSH meghatározása (Thyreoidea-Stimuláló Hormon) |
28 |
2627Q |
Anti-Hbs AT kimutatása |
29 |
29950 |
DNS kivonása biológiai mintából |
30 |
28938 |
Oligonucleotid hibridizáció membráncsíkon próbapáronként |
31 |
28920 |
Polimeráz láncreakció (PCR) egy mintában primer páronként |
32 |
2627W |
Vírus ellenes AT meghatározása ELISA módszerrel |
33 |
2639L |
Hepatitis B vírus mennyiségi meghatározása bDNS módszerrel |
34 |
25572 |
Hepatitis B vírus gyógyszer-rezisztens mutánsainak meghatározása PCR alapú módszerrel |
35 |
2627U |
Hepatitis-D vírus AT kimutatása |
36 |
2661H |
Thyreoidea-peroxidáz elleni antitest meghatározása |
37 |
29000 |
Szövettani vizsgálat a szokásos feldolgozási módszerrel |
38 |
36130 |
Hasi (áttekintő, komplex) UH vizsgálat |
39 |
3613D |
Tranziens elasztográfia |
40 |
81581 |
UH vezérelt májbiopsia |
41 |
81580 |
Aspiratio hepatis |
42 |
92231 |
Immunmoduláció |
43 |
91311 |
Krónikus beteg dietetikai alapoktatása (gastroenterológiai, nephrológiai, onkológiai vagy 2. típusú diabeteses betegnél) |
7.3. A releváns HBCS kódok
|
A |
B |
1 |
HBCS |
HBCS megnevezés |
2 |
351B |
Májbetegségek, kivéve rosszindulatú daganatok, cirrhosis |
7.4. A releváns ATC kódok
|
A |
B |
1 |
ATC |
ATC megnevezés |
2 |
L03AB05 |
INF-alfa 2b |
3 |
L03AB11 |
peginterferon-alfa 2a |
4 |
L03AB04 |
INF-alfa 2a |
5 |
J05AF05 |
lamivudin |
6 |
J05AF10 |
entecavir |
7 |
J05AF08 |
adefovir dipivoxil |
8 |
J05AF07 |
tenofovir disoproxil |
8. Rövidítések:
ATC: Anatomical Therapeutic Chemical klasszifikáció
BNO: Betegségek nemzetközi osztályozása
HBCS: Homogén betegségcsoport
OENO: Orvosi eljárások nemzetközi osztályozása
HBV DNS: Hepatitisz B vírus DNS
HDV: Hepatitisz D vírus
HBsAg: Hepatitisz B vírus felületi antigén
HBeAg: Hepatitisz B vírus ’e’ antigén
IgM-antiHD: Hepatitisz D vírus elleni IgM típusú ellenanyag
INF: Interferon
Peg-INF: Pegilált interferon
ALT: Alanin aminotranszferáz
HAI: Hisztológiai aktivitási index
NA: Nukleoz(t)id analóg
PCR: Polymerase Chain Reaction
HCC: HepatoCelluláris Carcinoma
”
12. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
A felnőttkori luminális Crohn-betegség diagnosztikájának és kezelésének finanszírozási eljárásrendje
1. Az eljárásrend tárgyát képező betegség, betegcsoport megnevezése
1.1. Felnőttkori Crohn-betegség (luminális)
2. Kórkép leírása
A gyulladásos bélbetegségek (IBD), azaz a colitis ulcerosa és a Crohn-betegség a fejlettebb országokban a rheumatoid arthritis után a második leggyakoribb idült gyulladásos betegségcsoportot képezik. A Crohn-betegség krónikus gyulladásos betegség, amely a gasztrointesztinális traktus bármely területét érintheti, gyakori az intesztinális (pl.: szűkület vagy fisztula) és extraintesztinális szövődmények megjelenése. A betegség természetes lefolyása az esetek döntő többségében különböző súlyosságú fellángolások (relapsusok) és nyugalmi időszakok (remissziók) különböző időtartamú váltakozásából áll. A hagyományos terápiás lehetőségek hosszú távú klinikai eredménye a betegek jelentős részében nem megfelelő, a betegség egyes esetekben csak nagy dózisú és elhúzódó szteroid kezelésre reagál, mely a jelen eljárásrendben nem részletezett, akár súlyos mellékhatásokhoz is vezethet. A szteroid hatás időtartama azonban viszonylag rövid és a betegek kb. egyharmada már kezdettől fogva rezisztens a kezelésre, vagy később szteroid dependencia alakul ki. Hagyományosan a kezelés célja a remisszió elérése és fenntartása, lehetőleg a szövődmények kialakulása, ezáltal a műtéti kezelés elkerülése. A betegség természetes lefolyását a hagyományos gyógyszeres kezeléssel nem tudjuk megváltoztatni. Crohn-betegségben az évek során 70-80%-ban szűkület, fisztula, tályog alakul ki, reszekciós műtét válik szükségessé. Bár a betegség pontos oka nem tisztázott, a patogenezis megismert tényezői az utóbbi években lehetővé tették új típusú, úgynevezett biológiai gyógyszerek kifejlesztését. Ma a terápiás cél a klinikai és endoszkópos remisszió (nyálkahártya-gyógyulás) elérése, a szteroid mentes-remisszió fenntartása, a szövődmények megelőzése, a kórházi kezelések és sebészi kezelés szükségességének mérséklése, az életminőség javítása, a betegség természetes lefolyásának kedvező irányú megváltoztatása.
2.1. A Crohn-betegség aktivitása
A Crohn-betegség súlyosságának megítélésére az eltérő betegségtípusok esetén más-más mérőszámok alkalmasak. Gyulladásos típusú betegségben a CDAI (Crohn’s Disease Activity Index) a legelterjedtebben alkalmazott aktivitási index. A CDAI alapján történő besorolást és az annak megfelelő klinikai állapotot táblázatban részletezzük. A kezelést hatékonynak tekintjük (klinikai válasz), ha a CDAI 70 ponttal csökken, 150 pont alatt remisszióról beszélünk. A csak a felső gastrointestinalis traktust érintő luminalis Crohn-betegség esetén a CDAI nem minden esetben alkalmas a klinikai állapot megítélésére. A műtéti beavatkozás során esetleg kialakított hasfali vendégnyílás (stoma) a székletszám változásán keresztül befolyásolja a CDAI értékét, így ilyenkor az csak becsülhető.
2.2. A szteroid kezelés fő problémái
2.2.1. Szteroid refrakter IBD: ha legalább 0,75 mg/ttkg prednisolon mellett Crohn-betegség esetén 4 hét kezelés után is aktív a betegség.
2.2.2. Szteroid dependencia: ha 3 hónap alatt nem lehet relapszus nélkül 10 mg prednisolon alá csökkenteni a gyógyszer adagját, vagy elhagyása után 3 hónapon belül relapszus következik be.
3. Az ellátás igénybevételének finanszírozott szakmai rendje, finanszírozási algoritmusa
4. A felnőttkori Crohn-betegség gyógyszeres kezelési algoritmusa
4.1. Enyhe esetben alapellátásban terminális ileum érintettsége esetén 5-ASA, illetve budesonid, colon érintettsége esetén sulphasalazin kezelés megpróbálható,
4.2. kezdeti szteroid kezelés 3 hónapig,
4.3. korai immunszuppresszív terápia,
4.4. negyedik vonalban: biológiai terápia (biológiai terápia alkalmazására kijelölt intézmények); valamelyik TNF-α gátló alkalmazása: infliximab (az alkalmazott támogatási kategória figyelembevételével); adalimumab.
5. A Crohn-betegség biológiai kezelése
5.1. Indukciós kezelés gyulladásos típusú Crohn-betegségben (luminális): anti-TNF-α indukciós kezelés indikált bármely lokalizációban lévő középsúlyos-súlyos Crohn-betegségben (EL1a, RGB), ha az szteroid refrakter, vagy immunszuppresszáns kezelés mellett szteroid dependencia alakul ki, vagy immunszuppresszáns kezelésre a beteg intoleráns.
5.2. A Magyarországon jelenleg engedélyezett készítmények közül:
5.2.1. Infliximab (IFX) esetében: 5mg/ttkg intravénás infúzióban, 2 órás infundálási időtartamban a 0., 2. és 6. héten alkalmazva. Az indukciós kezelést követően 6 héten belül nem reagáló betegek további IFX-kezelését nem támasztják alá a rendelkezésre álló adatok.
5.2.2. Adalimumab (ADA) esetében: 80 mg a 0. héten, majd 40 mg a 2. héten. Ha hamarabb szükséges elérni a terápiás hatást, akkor a készítmény alkalmazható a 0. héten 160 mg (a dózis beadható 4 injekcióban egyetlen napon, vagy napi 2 injekcióban két egymást követő napon), a 2. héten 80 mg dózisban annak tudatában, hogy az indukciós kezelés során nagyobb a mellékhatások kockázata.
5.3. Az anti-TNF-α indukciós kezelés hatékonyságának ellenőrzése Crohn-betegségben
5.3.1. Luminalis Crohn-betegség estében az indukciós kezelést követő (12-14. hét) legalább 70 pontos CDAI esés (reagálás) vagy a CDAI 150 pont alá esése esetében (remisszió) az indukciós kezelést hatékonynak tekintjük.
5.3.2. Szteroid dependens kórforma esetében az anti-TNF-α kezelést hatékonynak tekintjük, ha az indukciós kezelés végére a szteroid dózisa legalább a felére csökkenthető. Kombinált kórformákban bármely fenti kritérium teljesítése esetében indokolt a fenntartó kezelés.
6. Fenntartó kezelés felnőttkori Crohn-betegségben (luminális)
6.1. Megfelelő válaszkészség (3 hónap alatt CDAI minimum 70 pontos csökkenése) esetén fenntartó kezelés folytatható önmagában vagy immunszuppresszív terápiával együtt. Extraintesztinális manifesztáció esetében a sikeresség elbírálásában a klinikai jelek javulása a mérvadó (EL3, RG C).
6.2. Infliximab esetében: Hatékony indukciós kezelést követően 8 hetente 5mg/ttkg dózisban.
6.3. Adalimumab esetében: Hatékony indukciós kezelést követően 2 hetente alkalmazott 40 mg dózisban. Reagáló esetekben a kezelés maximális időtartamára, elhagyására vonatkozó ajánlás nem fogalmazható meg (EL3, RG C).
7. Különleges megfontolások az anti-TNF-α kezeléshez
7.1. Készítményválasztás
Luminalis Crohn-betegség esetén a két hasonló támadáspontú szert összehasonlító vizsgálatára nem került sor, és a tanulmányok direkt összevetése nem megbízható, azonban az általános állásfoglalás alapján lényeges különbség a vegyületek hatásosságában nincs. Az anti-TNF-α készítmények és immunszuppresszáns szerek (pl.: azathioprin) kombinált alkalmazása előnyös lehet a hatékonyság szempontjából, de a kombinált immunszupresszió esetén gyakoribb mellékhatások (pl.: fertőzések) megjelenésével kell számolnunk, így minden esetben a kockázat és az előny gondos mérlegelése mellett lehetséges.
7.2. Dózismódosítás
7.2.1. Infliximab: Közepesen súlyos-súlyos, aktív Crohn-betegség esetében hatékony indukciós kezelést követően 8 hetente 5mg/ttkg dózisban, a kezdetben reagáló-remisszióba kerülő betegekben hatáscsökkenés-vesztés esetén a dózis 10 mg/ttkg-ra emelhető 8 hetente. Ilyenkor fontos azonban a hatásvesztés okának tisztázása, infekció (pl. Clostridium difficile), abscessus, műtétet igénylő szűkület kizárása.
7.2.2. Adalimumab: A javasolt adag 40 mg minden 2. héten, szubkután injekcióban a kezdetben reagáló-remisszióba kerülő betegekben hatáscsökkenés-vesztés esetén a 40 mg-os injekciók adása közötti időintervallum egy hétre csökkenthető. Ilyenkor fontos azonban a hatásvesztés okának tisztázása, infekció (pl. Clostridium difficile) abscessus, műtétet igénylő szűkület kizárása.
7.3. Készítményváltás: anti-TNF-α kezelés során a terápiás válasz elvesztése után, vagy intolerancia esetén másik szerre való váltás megengedett. Jelenleg két anti-TNF-α készítmény áll rendelkezésre Magyarországon ebben az indikációban, közöttük főszabályként váltás csak egy alkalommal javasolt. A váltás előtt szükséges az aktivitás felmérése, szövődmények (elsősorban infekció, abscessus, műtétet igénylő szűkület) kizárása.
8. Szövődmények monitorozása, ellenőrzése
8.1. Opportunista infekciók
8.2. Malignus betegségek
8.3. Neurológiai eltérések
8.4. Secunder autoimmun betegségek
9. Evidencia szintek és az ajánlások foka (Oxford Centre for Evidence Based Medicine)
9.1. Evidencia szint* (EL):
EL: 1a Randomizált kontrollált tanulmány (RCT), Systematic review (SR)
EL: 1b Individuális RCT (szűk konfidencia intervallummal)
EL: 1c Megfelelő
EL: 2a SR (cohort tanulmányok homogének)
EL: 2b Individuális cohort tanulmány (low qualitiy RCT)
EL: 2c „Outcomes” research
EL: 3a SR eset-kontrollált tanulmányok homogenitásával
EL: 3b Individuális eset-kontrollált tanulmány
EL: 4 Eset-sorozatok (rossz minőségű cohort és eset-kontrollált tanulmány)
EL: 5 Szakértői vélemény
* Terápiás tanulmány alapja
9.2. Ajánlás foka (RG):
RG: A 1. evidencia szintű, helytálló tanulmányok
RG: B 2. vagy 3. evidencia szintű, helytálló tanulmányok, vagy extrapolációk az 1. szintű tanulmányokból
RG: C 4. evidencia szintű, helytálló tanulmányok, vagy extrapolációk a 2. vagy 3. szintű tanulmányokból
RG: D 5. szintű evidenciák, zavarosan inkonzisztens vagy inkonkluzív tanulmányok bármely szinten
10. Luminalis Crohn-betegség kiterjedés és aktivitás szerint
10.1. Ileocoecalis Crohn-betegség
(5A) Enyhén aktív (CDAI: 151-220)
Enyhe tünetek, kezelés nem szükséges (EL5, RG D)
Mesalazin - értéke korlátozott (EL1a, RG B)
Budesonid 9 mg/nap (EL2a, RG B)
Antibiotikum nem ajánlott (EL1b, RG A)
(5B) Közepesen aktív (CDAI: 221-450)
Budesonid 9 mg/nap (EL1a, RG A)
Oralis szteroid 1 mg/kg (EL1a, RG A)
Antibiotikum (septicus esetben) (EL5, RG D)
AZA/6-MP vagy MTX (EL1b, RG B)
Anti-TNF-α (CDAI>300 esetén finanszírozott) (EL1b, RG B): változatlan aktivitás esetén, vagy szteroid – refrakter, dependens, intoleráns esetben
(5C) Súlyosan aktív (CDAI: >450)
Oralis szteroid 1 mg/kg (EL1a, RG A)
Ha a relapszus ritka: oralis szteroid és immunmodulátor
Relapszus esetén anti-TNF-α (EL1a, RG B csak infliximab): immunmodulátorral vagy nélküle
A sebészi megoldás alternatíva lehet (EL5 RG D)
10.2. Vastagbél Crohn-betegség
(5D) Enyhén aktív (CDAI: 151-220)
Sulfasalazin (EL1b, RG A)
Oralis szteroid (EL1a, RG A)
Ha a relapszus ritka: oralis szteroid és immunmodulátor
(5D) Közepes vagy súlyosan aktív (CDAI>220)
Relapszus esetén anti-TNF-α (CDAI>300 esetén finanszírozott): immunmodulátorral vagy nélküle (EL1a, RG B csak infliximab)
A sebészi megoldás alternatíva lehet (EL5, RG D)
10.3. Kiterjedt vékonybél Crohn-betegség
(5E) Enyhén aktív (CDAI: 151-220)
Orális szteroid és AZA/6-MP vagy MTX (EL5, RG D)
(5E) Közepes vagy súlyosan aktív (CDAI > 220)
Relapszus esetén anti-TNF-α (CDAI>300 esetén finanszírozott): immunmodulátorral, vagy nélküle (EL5, RG D)
Hyperalimentáció (EL4, RG C)
Sebészi megoldás alternatíva lehet
10.4. Várhatóan rossz prognózisú klinikai képpel járó eset
Korai AZA/6-MP/MTX, illetve anti-TNF-α terápia: [fiatalkori kezdet (<40 év) és perianalis CD] (EL5 RG D)
10.5. 10.5. Nyelőcső, illetve gastroduodenalis Crohn-betegség
(5G) Enyhén aktív
PPI kezelés (EL5, RG D)
Oral szteroid + PPI (EL4, RG C)
Oral szteroid + PPI + AZA vagy MTX (EL4, RG D)
(5G) Közepes/súlyos aktivitásban/refrakter esetben
Anti-TNF-α (szteroid refrakter esetben finanszírozott) (EL4, RG D)
Obstructio esetén dilatáció/sebészi megoldás (EL4, RG C)
11. Aktivitási score-ok gyulladásos bélbetegségben
11.1. CDAI score (Best és mtsi, Gut, 1979).
|
A |
B |
C |
D |
1 |
Jellemző |
Pontszám
(egy hétre) |
Súlyszám |
Részösszeg |
2 |
folyékony vagy rendkívül híg székürítés száma a megelőző 7 napon |
|
x2 |
= |
3 |
A hasi fájdalom/görcsök intenzitása
(a megfelelő 7 nap pontszámai összesen)
0=nem volt
1=enyhe
2=közepes
3=heves |
|
x5 |
= |
4 |
Általános közérzet
(a megfelelő 7 nap pontszámai összesen)
0=általában jó
1=átlag alatti
2=rossz
3=rendkívül rossz
4=szörnyű |
|
x7 |
= |
5 |
Crohn-betegséggel összefüggő tünetek száma:
A=arthritis/ízületi fájdalom
B=iritis/uveitis
C=erythema nodosum/pyoderma/stomatitis
D=fissura ani, fisztula/abscessus perianalis
E=egyéb fistula
F=37,8°C feletti láz a megelőző 7 napban |
|
x20 |
|
6 |
Hasmenés elleni gyógyszeres kezelés
(pl. loperamid, diphenoxylat, opiátok)
0=nem
1=igen |
|
x30 |
|
7 |
Hasi terime
0=nincs
2=bizonytalan
5=egyértelmű |
|
x10 |
|
8 |
Hematokrit
Férfiak (47 - Htk) = pontszám
Nők (42 - Htk) = pontszám |
|
X6 |
|
9 |
Aktuális testsúly (ATS):
Rendes testsúly: |
|
x1 |
|
10 |
(Rendes testsúly - ATS)/ rendes testúly x 100%=pont |
|
|
|
11 |
|
|
|
Összesen: |
12. Gyulladásos típusú Crohn-betegség klinikai súlyosságának meghatározása
12.1. Enyhe-középsúlyos betegség: járóbeteg, láztalan, hasi fájdalom nem jelentős, súlyvesztés nem haladja meg az eredeti testsúly 10%-át; nincsen hasi izomvédekezés, tapintható szövetmassza vagy kiszáradás jelei. (CDAI 150-220)
12.2. Középsúlyos-súlyos beteg: az a beteg, aki az enyhe-középsúlyos betegségre indikált gyógyszerekre nem reagál, lázas, testsúlyvesztése jelentős (>10%), hasi fájdalma van, sipolyképződéssel járó betegsége van, időszakosan hányinger vagy hányás gyötri (mely még nem utal bélelzáródásra), vérszegénysége jelentős. (CDAI: 220-450)
12.3. Súlyos-fulmináns betegség: szájon át alkalmazott szteroid, illetve immunszupprimáló kezelésre nem reagáló beteg, magas lázzal, gyakori hányással, bélelzáródásra utaló egyéb tünetekkel, hasi izomvédekezéssel, jelentős fogyással vagy hasi tályogra utaló klinikai jellel. (CDAI>450)
13. Az indikációk definiálása
13.1. Klasszikus terápia rezisztens Crohn-betegség (3 hónapon keresztül szteroid és optimalizált dózisú immunszuppresszánsra nem reagáló beteg).
13.2. Szteroid függő Crohn-betegség (a szakmai ajánlások szerinti fokozatos szteroid leépítés során egymást követő 2 alkalommal a betegség aktivitása ismét súlyossá válik).
13.3. Akut, terápia rezisztens Crohn-betegség [4 hét teljes dózisú szteroidra nem reagáló beteg, a betegség aktivitása mindvégig súlyos (CDAI>300), immunszuppresszáns terápia megkezdésére nincs idő, hiszen a készítmények 8-12 hét alatt érik el a terápiás hatást].
14. A Crohn-betegség betegnaplójának adatai
14.1. Általános adatok (név, TAJ-szám, diagnózis, dátum a kezdőnap és zárónap feltüntetésével)
14.2. Laza, hasmenéses székletek számának napi bontásban és összesítve, 7 napra történő feltüntetése
14.3. A hasi fájdalom mértékének napi bontásban és összesítve, 7 napra történő feltüntetése (0=nincs, 1=enyhe, 2=tűrhető, 3=erős)
14.4. Általános állapot napi feltüntetése (0=jó, 1=megfelelő, 2=rossz, 3=nagyon rossz, 4=tűrhetetlen)
14.5. A héten észlelt tünetek feltüntetése (0=nem volt/nincs, 1=volt/van): szem tünet; bőr tünet; belső sipoly; láz 37,5 fok felett; ízületi fájdalom; száj-garat fekély; végbél fisszúra, fisztula, tályog; egyéb tünet; megjegyzés
14.6. A hasmenés miatt gyógyszer (bélmozgást csökkentő szerek) bevételére vonatkozó heti adat (0=nem, 1=igen)
14.7. Aktuális testsúly (kg)
15. A finanszírozás szakmai ellenőrzésének alapját képező ellenőrzési sarokpontok
15.1. Adminisztratív ellenőrzési pontok (folyamatba épített ellenőrzés)
15.1.1. Kompetencia szint: intézményi és szakorvosi kompetencia ellenőrzése
15.1.2. Betegadatok (online TAJ ellenőrzés)
15.1.3. Jogszabályban rögzített indikációs terület BNO ellenőrzése
15.2. Szakmai ellenőrzési pontok
Klinikai súlyosság meghatározása egy rögzítést megelőző héten vezetett betegnapló alapján számított Crohn-betegség aktivitási index (CDAI) (kivéve kizárólag felső gastrointestinalis érintettség és sztómával élő beteg esetén, utóbbi esetekben szteroid függőség vagy rezisztencia esetén a szteroid dózis legalább 50%-os csökkenése az ellenőrzés szempontja, de sztómával élő beteg esetén a székletszámot nem tartalmazó CDAI rögzítése is szükséges!).
15.2.1. Inaktív betegség: CDAI≤150
15.2.2. Enyhe betegség: 150 <CDAI≤220
15.2.3. Közepesen súlyos: 220<CDAI≤300
15.2.4. Súlyos: 300<CDAI≤450
15.2.5. Nagyon súlyos: CDAI>450
15.3. A biológiai terápia kontraindikációinak kizárása és ellenőrzése
15.3.1. TBC kizárása (mellkas RTG)
15.3.2. Egyéb akut és krónikus fertőzések kizárása (pl.: hepatitis B és C)
15.3.3. Demyelinizációs betegség, SLE kizárása (anamnesztikus adatok alapján)
15.3.4. Terhesség kizárása az indukciós kezelés előtt, majd rendszeres ellenőrzés anamnesztikus adatok alapján, terhesség gyanúja esetén laboratóriumi vizsgálattal
15.3.5. Életvitel módja (fertőzésveszély, tájékoztatás a fertőzés megelőzés módjairól)
15.4. A kezelés monitorizálásának ellenőrzése (kontrollvizsgálat)
15.4.1. 3 havonta: labor (WE, Fvs, CRP, ASAT, ALAT, GGT, Karb, Kreat, Na, K)
15.4.2. 3 havonta: aktivitási index (CDAI meghatározása és dokumentálása)
15.4.3. szteroid refrakter esetben, kizárólag felső gastrointestinalis érintettség esetén a szteroid dózisának legalább 50%-os csökkentése az indukciós kezelés végéig
15.4.4. 6 havonta: mellkas RTG (tüdőgyulladás, TBC kizárása céljából)
15.4.5. 9 hónap óta tartó fenntartó kezelés után, újabb 6 hónapnál hosszabb teljes remisszió (CDAI alacsonyabb, mint 150 pont három egymást követő meghatározás alkalmával) esetén a kezelés felfüggesztése mérlegelésének dokumentálása
15.4.6. 9 hónap óta tartó fenntartó kezelés után, a kezelés tartós folytatása esetén 12 havonta ellenőrző képalkotó vizsgálat (MR vagy endoszkópia, indokolt esetben CT) dokumentálása, valamint 12 havonta hepatitis B és C szűrés, hepatitis B vaccinatio esetén annak dokumentálása
A biológiai terápia során az alkalmazott gyógyszerkészítmények alkalmazási előírásában és az egészségügyi szakellátás társadalombiztosítási finanszírozásának egyes kérdéseiről szóló 9/1993. (IV. 2.) NM rendelet 1/A. számú mellékletének vonatkozó indikációs pontjaiban foglaltakat egyaránt szükséges figyelembe venni. 15.5. Megjegyzés
15.5.1. Immunszuppresszív, immunmoduláns terápia: legalább 2 mg/ttkg, vagy intolerancia esetén a legmagasabb tolerálható dózisú AZA kezelés 3 hónapon át
15.5.2. TNF alfa gátlók: adalimumab, infliximab
16. A finanszírozási eljárásrend alkalmazásának hatását mérő minőségi indikátorok
16.1. A területre fordított közkiadások alakulása, monitorozása.
16.2. A helyes, finanszírozási algoritmus szerint kezelt betegek aránya.
17. A finanszírozás szempontjából lényeges finanszírozási kódok
17.1. A releváns BNO kódok
|
A |
B |
1 |
Kód |
Elnevezés |
2 |
K5001 |
Terápiarezisztens vékonybél Crohn-betegség |
3 |
K5011 |
Terápiarezisztens vastagbél Crohn-betegség |
4 |
K5081 |
Terápiarezisztens vastag- és vékonybél Crohn-betegség |
5 |
K5012 |
Vastagbél Crohn-betegség fisztulával |
6 |
K5082 |
Vékony- és vastagbél Crohn-betegség fisztulával |
17.2. A releváns ATC kódok
|
A |
B |
C |
D |
1 |
ATC kód |
Hatóanyag |
Kategória |
Megjegyzés |
2 |
A07EC01 |
sulfasalazin |
DMARD |
Betegségmódosító szerek |
3 |
A07EC02 |
mesalasin |
DMARD |
Betegségmódosító szerek |
4 |
L04AX01 |
azathioprin |
DMARD |
Betegségmódosító szerek |
5 |
L04AB02 |
infliximab |
BRMD |
Biológiai terápia eszközei |
6 |
L04AB04 |
adalimumab |
BRMD |
Biológiai terápia eszközei |
7 |
H02AB01 |
betamethason |
Szteroid |
Szteroid gyógyszerek |
8 |
H02AB04 |
metilprednizolon |
Szteroid |
Szteroid gyógyszerek |
9 |
H02AB06 |
prednizolon |
Szteroid |
Szteroid gyógyszerek |
10 |
H02AB09 |
hidrokortizon |
Szteroid |
Szteroid gyógyszerek |
11 |
A07EA06 |
budesonid |
Szteroid |
Szteroid gyógyszerek |
18. Rövidítések:
ATC: Anatomical Therapeutic Chemical klasszifikáció
BNO: Betegségek nemzetközi osztályozása
”
13. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
A felnőttkori fisztulázó Crohn-betegség diagnosztikájának és kezelésének finanszírozási eljárásrendje
1. Az eljárásrend tárgyát képező betegség, betegcsoport megnevezése
Felnőttkori fisztulázó Crohn-betegség
2. Kórkép leírása
A gyulladásos bélbetegségek (IBD), azaz a colitis ulcerosa és a Crohn-betegség a fejlettebb országokban a rheumatoid arthritis után a második leggyakoribb idült gyulladásos betegségcsoportot képezik. A Crohn-betegség krónikus gyulladásos betegség, amely a gasztrointesztinális traktus bármely területét érintheti, gyakori az intesztinális (pl.: szűkület vagy fisztula) és extraintesztinális szövődmények megjelenése. A betegség természetes lefolyása az esetek döntő többségében különböző súlyosságú fellángolások (relapsusok) és nyugalmi időszakok (remissziók) különböző időtartamú váltakozásából áll. A hagyományos terápiás lehetőségek hosszú távú klinikai eredménye a betegek jelentős részében nem megfelelő, a betegség egyes esetekben csak nagy dózisú és elhúzódó szteroid kezelésre reagál, mely a jelen eljárásrendben nem részletezett, akár súlyos mellékhatásokhoz is vezethet. A szteroid hatás időtartama azonban viszonylag rövid és a betegek kb. egyharmada már kezdettől fogva rezisztens a kezelésre, vagy később szteroid dependencia alakul ki. Perianalis fistulák kezelésében a szisztémás szteroid kezelés nem indokolt. Hagyományosan a kezelés célja a remisszió elérése és fenntartása, lehetőleg a műtét elkerülése. A betegség természetes lefolyását a hagyományos gyógyszeres kezeléssel bizonyosan nem tudjuk megváltoztatni. Crohn-betegségben az évek során 70-80%-ban szűkület, fisztula, tályog alakul ki, reszekciós műtét válik szükségessé. Bár a betegség pontos oka nem tisztázott, a patogenezis megismert tényezői az utóbbi években lehetővé tették új típusú, úgynevezett biológiai gyógyszerek kifejlesztését. Ma a terápiás cél a fisztulázó Crohn-betegség esetén a fistulák záródása, párhuzamos luminalis érintettség esetén a klinikai és endoszkópos remisszió (nyálkahártya-gyógyulás) elérése, a szteroid mentes remisszió fenntartása, a szövődmények megelőzése, a kórházi kezelések és sebészi kezelés szükségességének mérséklése, az életminőség javítása, a betegség természetes lefolyásának kedvező irányú megváltoztatása.
2.1. A felnőttkori fisztulázó Crohn-betegség aktivitása
A perianalis sipollyal járó betegségformák súlyosságának meghatározására a PDAI (Perianal disease Activity Index) alkalmas (EL5, RG D). PDAI 3 pontos csökkenésekor hatékonynak tartjuk a kezelést (klinikai választ), a remissziót a PDAI alapján a szakirodalom nem definiálja, azonban a sipolyváladékozás teljes megszűnése remissziónak tekinthető (EL2b, RG D). Crohn-betegséghez kapcsolt enterocutan vagy rectovaginalis sipolyok esetén részleges remissziónak tekinthető, ha a kezelés kezdetén aktív fisztulák váladékozása 3 hétnél hosszabb kezelést követően több, mint 50%-kal csökken két egymást követő kontroll vizsgálat során. A sipolyváladékozás teljes megszűnése 2 egymást követő kontroll vizsgálat alkalmával remissziónak tekinthető.
3. Az ellátás igénybevételének finanszírozott szakmai rendje, finanszírozási algoritmusa
4. A felnőttkori fisztulázó Crohn-betegség biológiai kezelése
4.1. Indukciós kezelés sipolyozó Crohn-betegségben
Komplex perianális (több sipolynyílású, magas transphinctericus vagy tályoggal szövődött, gyulladt rectum nyálkahártya mellett kialakuló, vagy rectovaginalis helyzetű) vagy enterocutan fisztula esetén második vonalban [antibiotikum és azathioprin kezelés elégtelensége (PDAI >4) vagy intoleranciája esetén] indikált az anti-TNF-α kezelés (EL1a, RGB). Fisztulázó betegségtípusban az első vonalbeli kezelésnek nem része a szisztémás szteroidok alkalmazása. A tályogot drenáló fisztula anti-TNF-α kezelése csak a tályog drenálása (seton behelyezése) után kezdhető meg.
4.2. A Magyarországon jelenleg engedélyezett készítmények közül:
4.2.1. Infliximab esetében: 5 mg/ttkg intravénás infúzióban, 2 órás infundálási időtartamban a 0., 2. és 6. héten alkalmazva. A 10-12. hétig nem reagáló betegek további infliximab kezelését nem támasztják alá a rendelkezésre álló adatok.
4.2.2. Az adalimumab törzskönyvi indikációja nem emeli ki a fisztulával járó Crohn-betegség kezelését, azonban nem is tiltja.
4.3. Az anti-TNF-α indukciós kezelés hatékonyságának ellenőrzése fisztulázó Crohn-betegségben
Fisztulázó kórforma esetében hatékony a kezelés, ha megfelelő fisztula-gyógyulás (PDAI csökkenés>3 pont, vagy ha a drenáló fisztulák számának, illetve a váladékozás mennyiségének legalább 50%-os csökkenése) igazolható.
5. Fenntartó kezelés fisztulázó Crohn-betegségben
5.1. Megfelelő válaszkészség (3 hónap alatt a drenáló fisztulák számának, illetve a váladékozás mennyiségének legalább 50%-os csökkenése vagy a PDAI>3 pontos csökkenése) esetén fenntartó kezelés folytatása javasolt önmagában vagy immunszuppresszív terápiával együtt.
5.2. Infliximab esetében: Hatékony indukciós kezelést követően 8 hetente 5 mg/ttkg dózisban.
5.3. Adalimumab esetében: Hatékony indukciós kezelést követően 2 hetente alkalmazott 40 mg dózisban. Reagáló esetekben a kezelés maximális időtartamára, elhagyására vonatkozó ajánlás nem fogalmazható meg (EL3, RG C).
6. Különleges megfontolások az anti-TNF-α kezeléshez
6.1. Készítményválasztás
Luminalis Crohn-betegség esetén a két hasonló támadáspontú szer összehasonlító vizsgálatára nem került sor, és a tanulmányok direkt összevetése nem megbízható, azonban az általános állásfoglalás alapján lényeges különbség a vegyületek hatásosságában nincs. Sipolyozó betegségformában az IFX EL1b, RG A erősségű, az ADA EL1b, RG B erősségű ajánlással alkalmazható. Kombinált immunszupresszió esetén gyakoribb infekciós mellékhatások megjelenésével kell számolnunk.
6.2. Dózismódosítás
6.2.1. Infliximab: Fisztula-képződéssel járó aktív Crohn-betegség esetén alkalmazott IFX kezelés esetében hatékony indukciós kezelést követően 8 hetente 5 mg/ttkg dózisban, a kezdetben reagáló-remisszióba kerülő betegekben hatáscsökkenés-vesztés esetén a dózis 10 mg/ttkg-ra emelhető 8 hetente. Ilyenkor fontos azonban a hatásvesztés okának tisztázása abscessus, műtétet igénylő szűkület kizárása.
6.2.2. Adalimumab: A javasolt adag 40 mg minden 2. héten, szubkután injekcióban a kezdetben reagáló-remisszióba kerülő betegekben hatáscsökkenés-vesztés esetén a 40 mg-os injekciók adása közötti időintervallum egy hétre csökkenthető. Ilyenkor fontos azonban a hatásvesztés okának tisztázása, abscessus, műtétet igénylő szűkület kizárása.
6.3. Készítményváltás
Anti-TNF-α kezelés során a terápiás válasz elvesztése után, vagy intolerancia esetén egy másik szerre való váltás megengedett. Jelenleg két anti-TNF-α készítmény áll rendelkezésre ebben az indikációban, közöttük főszabályként váltás csak egy alkalommal javasolt. A váltás előtt szükséges az aktivitás felmérése, szövődmények (abscessus, műtétet igénylő szűkület) kizárása.
7. Szövődmények monitorozása, ellenőrzése
7.1. Opportunista infekciók
7.2. Malignus betegségek
7.3. Neurológiai eltérések
7.4. Secunder autoimmun betegségek
8. Evidencia szintek és az ajánlások foka (Oxford Centre for Evidence Based Medicine)
8.1. Evidencia szint* (EL):
EL: 1a Randomizált kontrollált tanulmány (RCT), Systematic review (SR)
EL: 1b Individuális RCT (szűk konfidencia intervallummal)
EL: 1c Megfelelő
EL: 2a SR (cohort tanulmányok homogének)
EL: 2b Individuális cohort tanulmány (low qualitiy RCT)
EL: 2c „Outcomes” research
EL: 3a SR eset-kontrollált tanulmányok homogenitásával
EL: 3b Individuális eset-kontrollált tanulmány
EL: 4 Eset-sorozatok (rossz minőségű cohort és eset-kontrollált tanulmány)
EL: 5 Szakértői vélemény
* Terápiás tanulmány alapja
8.2. Ajánlás foka (RG):
RG: A 1. evidencia szintű, helytálló tanulmányok
RG: B 2. vagy 3. evidencia szintű, helytálló tanulmányok, vagy extrapolációk az 1. szintű tanulmányokból
RG: C 4. evidencia szintű, helytálló tanulmányok, vagy extrapolációk a 2. vagy 3. szintű tanulmányokból
RG: D 5. szintű evidenciák, zavarosan inkonzisztens vagy inkonkluzív tanulmányok bármely szinten
9. Fisztulázó Crohn-betegség kezelésének finanszírozott terápiás alkalmazásai
(9F) 1. perianalis tályog = sebészi megoldás (EL5, RG D)
9.1. Fisztula jellege szerint:
9.1.1. Egyszerű fisztula
9.1.2. Összetett fisztula rendszer
9.1.3. Kimenetel-fisztula
9.1.4. Rectovaginalis fisztula
9.2. Egyszerű fisztula
(9G) A fisztula csak panaszok esetén kezelendő
Panaszok esetén seton vagy fistulotomia (EL3, RG D)
Metronidazol és ciprofloxacin kezelés (EL3, RG D)
9.3. Összetett fisztularendszer
(9H) Összetett (komplex fisztula)
Sebészi seton ellátás javasolt (EL4, RG D)
Eltávolítása a kezelés sikerétől függ
(9I) Komplex kezelés
Az aktív luminalis Crohn-betegség kezelése szükséges a sebészi ellátás mellett (EL5, RG D)
(9J) Összetett (komplex fisztula)
Antibiotikum és AZ/6-MP az első terápia a sebészi ellátás mellett (EL4, RG D)
(9K) Második vonal
Infliximab (EL1b, RG A)
Adalimumab (EL1b, RG B)
Mindkét szer a második vonalban (EL1b, RG B)
9.4. Kimenetel-fisztula
(9L) Terápiás hatékonyság és mérése
Váladékozás csökkenése (50%) (EL2b, RG D)
Quantitatív - PDAI (EL5, RG D)
Váladékozás csökkenése (50%) és kismedence MRI vizsgálat (EL2b, RG D)
(9M) Terápia vezetése
AZA/6-MP (EL2b, RG C)
Infliximab (EL1b, RG A)
Adalimumab (EL1b, RG B)
Seton drain (EL4 RG D)
Drainage és gyógyszeres kombináció (EL3 RG C)
Bármelyik fenntartó kezelés legalább 1 évig szükséges (EL1b, RG A)
(9N) Hatástalanság
Hatástalan anti-TNF-α esetén tacrolimus vagy (EL1b, RG B) AZA/MTX és
antibiotikum (EL5, RG D)
Refrakter esetben diverzió (EL4, RG C)
Proctectomia az utolsó lépés (EL5, RG D)
(9O) Ellátás
Egyszerű anal-introital, tünet nélküli fistula nem kíván kezelést (EL5, RG D)
9.5. Rectovaginalis
(9P) Rectovaginalis fisztula
Tünettel járó esetben sebészeti kezelés előtt, aktív Crohn-betegségben (különösen a rectalis), előtte kezelendő (EL5, RG D)
9.6. Fisztula aktivitásának mérése szerint
9.6.1. Váladékozás mértéke alapján: Fisztula hozamának csökkenése 50%-kal
9.6.2. Összetett pontszám alapján: Perianal Disease Activity Index (PDAI)
10. Aktivitási score fisztulázó Crohn-betegségben
10.1. Sipolyozó Crohn-betegség súlyosságának meghatározása (PDAI) (Irvine és mtsi, Journal of Clinical Gastroenterology, 1995)
|
A |
B |
1 |
Fisztula hozama |
|
2 |
nem váladékozik |
0 |
3 |
kis nyákos váladékozás |
1 |
4 |
közepes nyákos vagy gennyes váladékozás |
2 |
5 |
jelentős váladékozás |
3 |
6 |
fekulens váladékozás |
4 |
7 |
Fájdalom / aktivitás korlátozottsága |
|
8 |
tevékenységben nem korlátoz |
0 |
9 |
enyhe diszkomfort, korlátozottság nélkül |
1 |
10 |
közepes diszkomfort, bizonyos tevékenységek gátoltak |
2 |
11 |
jelentős diszkomfort, jelentős korlátozottság |
3 |
12 |
súlyos fájdalom és korlátozottság |
4 |
13 |
Szexuális aktivitás korlátozottsága |
|
14 |
nincs korlátozottság |
0 |
15 |
enyhe korlátozottság |
1 |
16 |
közepes korlátozottság |
2 |
17 |
jelentős korlátozottság |
3 |
18 |
szexuális funkciók gátoltak |
4 |
19 |
Perianalis betegség típusa |
|
20 |
nincs perianális megjelenés/skin tag |
0 |
21 |
fissura vagy „mucosal tear” |
1 |
22 |
kevesebb, mint 3 fisztula |
2 |
23 |
több, mint 3 fisztula |
3 |
24 |
sphincterkárosodás vagy jelentős perianalis hámhiány |
4 |
25 |
Beszűrtség foka |
|
26 |
nincs beszűrtség |
0 |
27 |
minimális beszűrtség |
1 |
28 |
közepes beszűrtség |
2 |
29 |
jelentős beszűrtség |
3 |
30 |
tályog |
4 |
11. A Crohn-betegség betegnaplójának adatai
11.1. Általános adatok (név, TAJ-szám, diagnózis, dátum a kezdőnap és zárónap feltüntetésével)
11.2. Laza, hasmenéses székletek számának napi bontásban és összesítve, 7 napra történő feltüntetése
11.3. A hasi fájdalom mértékének napi bontásban és összesítve, 7 napra történő feltüntetése (0=nincs, 1=enyhe, 2=tűrhető, 3=erős)
11.4. Általános állapot napi feltüntetése (0=jó, 1=megfelelő, 2=rossz, 3=nagyon rossz, 4=tűrhetetlen)
11.5. A héten észlelt tünetek feltüntetése (0=nem volt/nincs, 1=volt/van): szem tünet; bőr tünet; belső sipoly; láz 37,5 fok felett; ízületi fájdalom; száj-garat fekély; végbél fisszúra, fisztula, tályog; egyéb tünet; megjegyzés
11.6. A hasmenés miatt gyógyszer (bélmozgást csökkentő szerek) bevételére vonatkozó heti adat (0=nem, 1=igen)
11.7. Aktuális testsúly (kg)
12. A finanszírozás szakmai ellenőrzésének alapját képező ellenőrzési sarokpontok
12.1. Adminisztratív ellenőrzési pontok (folyamatba épített ellenőrzés)
12.1.1. Kompetencia szint: intézményi és szakorvosi kompetencia ellenőrzése
12.1.2. Betegadatok (online TAJ ellenőrzés)
12.1.3. Jogszabályban rögzített indikációs terület BNO ellenőrzése
12.2. Szakmai ellenőrzési pontok
12.2.1. A diagnózis kritériumainak rögzítése (BNO: K5012, K5082)
12.2.1.1. A fisztula típusának meghatározása a fizikális status, endoszkópos lelet és a kismedencei képalkotók (MR vagy rectalis UH) vagy EUA (anesztéziában végzett rectalis vizsgálat) alapján
12.2.1.2. Súlyosság meghatározása az alábbi kritériumok alapján (PDAI: perianalis betegség aktivitási index, 0-12)
12.2.1.3. Az indukciós kezelés hatásosságának rögzítése (PDAI csökkenés>3)
12.2.1.4. A 12.2.1.1. pontban felsorolt diagnosztikai módszerekkel igazolt remisszióig
12.2.2. A biológiai terápia kontraindikációinak kizárása és ellenőrzése
12.2.2.1. TBC kizárása (mellkas RTG)
12.2.2.2. Egyéb akut és krónikus fertőzések kizárása (pl.: hepatitis B és C szűrés)
12.2.2.3. Demyelinizációs betegség, SLE kizárása (anamnesztikus adatok alapján)
12.2.2.4. Terhesség kizárása az indukciós kezelés előtt, majd rendszeres ellenőrzés az anamnesztikus adatok alapján, terhesség gyanúja esetén laboratóriumi vizsgálattal
12.2.2.5. Életvitel módja (fertőzésveszély, tájékoztatás a fertőzés megelőzés módjairól)
12.2.2.6. Labor: rutin
12.2.3. A kezelés monitorizálásának ellenőrzése (kontrollvizsgálat)
12.2.3.1. 3 havonta: labor (WE, Fvs, CRP, ASAT, ALAT, GGT, Karb, Kreat, Na, K)
12.2.3.2. 3 havonta: aktivitási index (PDAI meghatározása és dokumentálása)
12.2.3.3. 6 havonta: mellkas RTG (tüdőgyulladás, TBC kizárása céljából)
A biológiai terápia során az alkalmazott gyógyszerkészítmények alkalmazási előírásában és az egészségügyi szakellátás társadalombiztosítási finanszírozásának egyes kérdéseiről szóló 9/1993. (IV. 2.) NM rendelet 1/A. számú mellékletének vonatkozó indikációs pontjaiban foglaltakat egyaránt szükséges figyelembe venni. Megjegyzés
12.2.3.4. Immunszuppresszív, immunmoduláns terápia: legalább 2 mg/ttkg, vagy intolerancia esetén a legmagasabb tolerálható dózisú AZA kezelés 3 hónapon át.
12.2.3.5. TNF alfa gátlók: adalimumab, infliximab (az alkalmazott támogatási kategória figyelembevételével).
12.2.3.6. Egy éven túli fenntartó kezelés feltétele az MR vagy rectalis UH vagy EUA vizsgálattal igazolt komplett fisztula-záródás.
13. A finanszírozási eljárásrend alkalmazásának hatását mérő minőségi indikátorok
13.1. A területre fordított közkiadások alakulása, monitorozása
13.2. A finanszírozási algoritmus szerint kezelt betegek aránya
14. A finanszírozás szempontjából lényeges finanszírozási kódok
14.1. A releváns BNO kódok
|
A |
B |
1 |
Kód |
Elnevezés |
2 |
K5001 |
Terápiarezisztens vékonybél Crohn-betegség |
3 |
K5011 |
Terápiarezisztens vastagbél Crohn-betegség |
4 |
K5081 |
Terápiarezisztens vastag- és vékonybél Crohn-betegség |
5 |
K5012 |
Vastagbél Crohn-betegség fisztulával |
6 |
K5082 |
Vékony- és vastagbél Crohn-betegség fisztulával |
14.2. A releváns ATC kódok
|
A |
B |
C |
D |
1 |
ATC kód |
Hatóanyag |
Kategória |
Megjegyzés |
2 |
A07EC01 |
sulfasalazin |
DMARD |
Betegségmódosító szerek |
3 |
A07EC02 |
mesalazin |
DMARD |
Betegségmódosító szerek |
4 |
L04AX01 |
azathioprin |
DMARD |
Betegségmódosító szerek |
5 |
L04AB02 |
infliximab |
BRMD |
Biológiai terápia eszközei |
6 |
L04AB04 |
adalimumab |
BRMD |
Biológiai terápia eszközei |
7 |
H02AB01 |
betamethason |
Szteroid |
Szteroid gyógyszerek |
8 |
H02AB04 |
metilprednizolon |
Szteroid |
Szteroid gyógyszerek |
9 |
H02AB06 |
prednizolon |
Szteroid |
Szteroid gyógyszerek |
10 |
H02AB09 |
hidrokortizon |
Szteroid |
Szteroid gyógyszerek |
10 |
A07EA06 |
budesonid |
Szteroid |
Szteroid gyógyszerek |
15. Rövidítések:
ATC: Anatomical Therapeutic Chemical klasszifikáció
BNO: Betegségek nemzetközi osztályozása
”
14. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
A colitis ulcerosa diagnosztikájának és kezelésének finanszírozási eljárásrendje
1. Az eljárásrend tárgyát képező betegség, betegcsoport megnevezése
Colitis ulcerosa
2. Kórkép leírása
A gyulladásos bélbetegségek (IBD), azaz a colitis ulcerosa (CU) és a Crohn-betegség (CD) a fejlettebb országokban a rheumatoid arthritis után a második leggyakoribb idült gyulladásos betegségcsoportot képezik. A colitis ulcerosa a vastagbél nyálkahártyájának fekélyes gyulladása, mely a rectumtól kezdve különböző hosszúságban érintheti a vastagbelet, ritkán a terminális ileumot („back wash ileitis”). A colitis ulcerosa természetes lefolyása az esetek döntő többségében különböző súlyosságú fellángolások (relapsusok) és nyugalmi időszakok (remissziók) különböző időtartamú váltakozásából áll, az esetek egy részében az aktivitás folyamatos. A hagyományos terápiás lehetőségek hosszú távú klinikai eredménye a betegek jelentős részében nem megfelelő, a betegség egyes esetekben csak nagy dózisú és elhúzódó szteroid kezelésre reagál, mely a jelen eljárásrendben nem részletezett, akár súlyos mellékhatásokhoz is vezethet. A szteroid hatás időtartama azonban viszonylag rövid, és a betegek kb. egyharmada már kezdettől fogva rezisztens a kezelésre, vagy később szteroid dependencia alakul ki. Hagyományosan a kezelés célja a remisszió elérése és fenntartása, lehetőleg a műtéti kezelés elkerülése. Colitis ulcerosában gyakoriak a relapszusok, a betegség proximális irányban kiterjedtebbé válhat, az egész vastagbelet érintő esetek 10-20%-ában dysplasia, carcinoma alakul ki. A betegek 10-25%-a proctocolectomiára szorul. Bár a betegség pontos oka nem tisztázott, a patogenezis megismert tényezői az utóbbi években lehetővé tették új típusú, úgynevezett biológiai gyógyszerek kifejlesztését. Ma terápiás cél a klinikai, endoszkópos és szövettani remisszió (nyálkahártya-gyógyulás) elérése, a szteroid mentes remisszió fenntartása, a szövődmények megelőzése, a kórházi kezelések és sebészi kezelés szükségességének mérséklése, az életminőség javítása, a betegség természetes lefolyásának kedvező irányú megváltoztatása.
2.1. Colitis ulcerosa aktivitása
A Colitis ulcerosa betegség aktivitását a jelenlegi eljárásrend a részleges Mayo-score meghatározásával követi. A Mayo score alapján a betegség inaktív 0-3 pont között, 4-6 pont között enyhe aktivitású, 7-9 pont között közepes aktivitású, a 9-nél nagyobb Mayo score-ral rendelkező beteget pedig súlyos állapotúnak tekintjük.
2.1.1. Mayo score alapján a colitis ulcerosa klinikai súlyosságának meghatározása
inaktív colitis ulcerosa: 0-3 pont között
enyhe colitis ulcerosa: 4-6 pont között
közepes colitis ulcerosa: 7-9 pont között
súlyos colitis ulcerosa: 9 pont felett
2.1.2. Mayo Score (Disease Activity Index) (Schroeder és mtsi., New England Journal of Medicine, 1987). A részleges Mayo-score az endoszkópos subscore-t nem tartalmazza.
|
A |
B |
C |
D |
E |
1 |
|
0 |
1 |
2 |
3 |
2 |
Székletszám |
Normál |
1-2/nap >normál |
3-4/nap >normál |
5/nap >normál |
3 |
Rectalis vérzés |
Nincs |
Vércsíkok |
Egyértelmű |
Többségében vér |
4 |
Nyálkahártya |
Normál |
Enyhén sérülékeny |
Közepesen
sérülékeny |
Spontán vérzések |
5 |
Orvos általános megítélése |
Normál |
Enyhe |
Közepes |
Súlyos |
3. Az ellátás igénybevételének finanszírozott szakmai rendje, finanszírozási algoritmusa
4. A Colitis ulcerosa betegnaplójának adatai
4.1. Általános adatok (név, TAJ-szám, diagnózis, dátum a kezdőnap és zárónap feltüntetésével)
4.2. Székletek számának napi bontásban és átlagolva, 7 napra történő feltüntetése
4.3. Véres széklet számának napi bontásban és átlagolva, 7 napra történő feltüntetése
5. Szteroid kezelés fő problémái
5.1. Szteroid refrakter gyulladásos bélbetegség (IBD): akut, súlyos colitis ulcerosa esetében teljes dózisú parenterális szteroid kezelés ellenére 5 nap után is aktív a betegség.
5.2. Szteroid dependencia: ha 3 hónap alatt nem lehet relapszus nélkül 10 mg prednisolon alá csökkenteni a gyógyszer adagját, vagy elhagyása után 3 hónapon belül relapszus következik be.
6. Colitis ulcerosa biológiai kezelése
6.1. Indukciós kezelés súlyos, aktív colitis ulcerosában
6.1.1. Hagyományos kezelésre (5-aminoszalicilát, szteroid, immunszuppresszív szer) nem reagáló, vagy intoleráns, immunszuppresszív szer mellett szteroid dependens, vagy immunszuppresszív szerre intoleráns, közepesen súlyos, krónikusan aktív colitis ulcerosában 5 mg/ttkg IFX kezelés (a 0., 2. és 6. héten) vagy subcutan adalimumab terápia (0. héten 160 mg, 2. héten 80 mg, majd 2 hetente 40 mg sc. 3 hónapig) javasolt.
6.1.2. Súlyos, fulmináns, 5 napos intravénás szteroid kezelésre nem reagáló colitis ulcerosában a műtéti kezelés előtt megkísérelhető az 5 mg/ttkg dózisú IFX kezelés. Hatékonyság esetén a teljes indukciós kezelést (5 mg/ttkg IFX parenterálisan a 2. héten és 6. héten) alkalmazni kell.
6.2. Az anti-TNF-α indukciós kezelés hatékonyságának ellenőrzése colitis ulcerosában
A komplett indukciós kezelés hatékonyságának felmérésére a részleges Mayo-score javasolt.
6.2.1. Szteroid dependens colitis ulcerosa esetén alkalmazott infliximab kezelés hatékonynak tekinthető, ha változatlanul kielégítő klinikai státusz mellett a szteroid kezelés legalább 3 hónapon át elhagyhatóvá vált.
6.2.2. Szteroid rezisztens (nem fulmináns) colitis ulcerosa esetében a hatékonyság felmérésére a 12. héten alkalmazott, Mayo-subscore (endoszkópos vizsgálat nélkül) legalább 3 pontos csökkenése javasolt.
7. Fenntartó kezelés colitis ulcerosában
7.1. Az infliximabbal történt indukciós kezelés által elért remissziót követően indokolt infliximab fenntartó terápia alkalmazása a 14. héttől 5 mg/ttkg dózisban 8 hetente. A fenntartó kezelés hossza a rendelkezésre álló irodalmi adatok szerint pontosan nem meghatározott. Az egészségbiztosító a rendkívül költséges biológiai terápiához való egyenlő hozzáférés lehetőségére tekintettel maximum egy évig finanszírozza kiemelt indikációhoz kötött társadalombiztosítási támogatással, az alkalmazott támogatási kategória figyelembevételével. Inaktív állapotot követő relapszus esetén, hasonlóképpen a megelőző terápiára nem reagáló esetekben ismételt terápiás lehetőségként alkalmazható.
7.2. Az adalimumabbal történt indukciós kezelés által elért remissziót követően indokolt adalimumab fenntartó terápia alkalmazása a 12. héttől subcutan 40 mg dózisban 2 hetente. A fenntartó kezelés hossza nem meghatározott. Az egészségbiztosító a rendkívül költséges biológiai terápiához való egyenlő hozzáférés lehetőségére tekintettel maximum egy évig finanszírozza kiemelt indikációhoz kötött társadalombiztosítási támogatással. Inaktív állapotot követő relapszus esetén, hasonlóképpen a megelőző terápiára nem reagáló esetekben ismételt terápiás lehetőségként alkalmazható.
7.3. Amennyiben a relapszus a kezelés felfüggesztése után 6 hónapon belül lép fel, reindukciós kezelés sem infliximab, sem adalimumab esetén nem indokolt, a fenntartó kezelés folytatása javasolt, de a biológiai terápia újraindítása előtt a relapszus klinikai képét utánzó esetleges egyéb okok kizárása (pl.: infectio, szövődmények, stb.) szükséges!
8. Különleges megfontolások az anti-TNF-α kezeléshez
8.1. A készítményválasztás és készítményváltás kérdése:
Az infliximab bizonyítottan hatásos terápia refrakter indeterminált colitis és pouchitis eseteiben is. Az anti-TNF-α készítmény és más immunszuppresszáns szerek (pl. azathioprin vagy szteroid) kombinált alkalmazása a mellékhatások gyakoribb előfordulása miatt (pl.: fertőzéses szövődmények) a kockázat és előny mérlegelése után lehetséges.
8.2. Dózismódosítás
Az aktív colitis ulcerosa esetén alkalmazott infliximab kezelés esetében hatékony indukciós kezelést követően 8 hetente 5 mg/ttkg dózisban. Infliximab esetén a dózisemelést a törzskönyvi indikáció nem teszi lehetővé.
Ilyenkor amennyiben lehetséges, a hatásvesztés okának tisztázása javasolt.
Az aktív colitis ulcerosa esetén alkalmazott adalimumab kezelés esetében hatékony indukciós kezelést követően 2 hetente 40 mg dózisban. Adalimumab esetén a dózisemelést a törzskönyvi indikáció nem teszi lehetővé, de azon betegeknél, akiknél csökken a terápiás hatás, lehetőséget ad a 40 mg-os dózis hetenként történő alkalmazására. Ilyenkor amennyiben lehetséges, a hatásvesztés okának tisztázása javasolt.
Készítményváltás: anti-TNF-α kezelés során a terápiás válasz elvesztése után, vagy intolerancia esetén másik szerre való váltás megengedett. Jelenleg két anti-TNF-α készítmény áll rendelkezésre Magyarországon ebben az indikációban, közöttük főszabályként váltás csak egy alkalommal javasolt. A váltás előtt szükséges az aktivitás felmérése, szövődmények (pl. fertőzések) kizárása.
9. Emelt, indikációhoz kötött társadalombiztosítási támogatásal adható készítmények:
Salazopyrin intolerancia, illetve jelentős szisztémás szteroid mellékhatás esetén az életkorra vonatkozó indikációs megkötések és az adott készítmény alkalmazási előírásában szereplő javallatok figyelembe vételével: budesonid, mesalazin hatóanyagú készímények (Eü90, 11/b).
10. Szövődmények monitorozása, ellenőrzése
10.1. Opportunista infekciók
10.2. Malignus betegségek
10.3. Neurológiai eltérések
10.4. Indukált autoimmun kórképek
11. A felnőttkori colitis ulcerosa finanszírozásának ellenőrzési kritériumai
11.1. Adminisztratív ellenőrzési pontok (folyamatba épített ellenőrzés)
11.1.1. Kompetencia szint: intézményi és szakorvosi kompetencia ellenőrzése
11.1.2. Betegadatok (online TAJ ellenőrzés)
11.1.3. Jogszabályban rögzített indikációs terület BNO ellenőrzése
11.2. Szakmai ellenőrzési pontok
A diagnózis kritériumainak rögzítése (BNO: K5180, K5190) klinikai tünetek és endoszkópos lelet alapján. A betegség klinikai tüneteinek és aktivitásának meghatározása (a vizitet megelőző egy héten át vezetett betegnapló alapján) és dokumentálásának ellenőrzése (Mayo score).
11.2.1. Klinikai tünetek Mayo kritériumok alapján: Mayo score maximum 12 pont
11.2.2. Enyhe colitis ulcerosa (Mayo score ≤6)
11.2.3. Közepesen súlyos colitis ulcerosa (6< Mayo score ≤9)
11.2.4. Súlyos colitis ulcerosa (Mayo score >9)
11.3. A biológiai terápia kontraindikációinak kizárása és ellenőrzése
11.3.1. TBC kizárása (mellkas RTG)
11.3.2. Egyéb akut és krónikus fertőzések kizárása (pl.: hepatitis B és C szűrés)
11.3.3. Demyelinizációs betegség, SLE kizárása (anamnesztikus adatok alapján)
11.3.4. Terhesség kizárása az indukciós kezelés előtt, majd rendszeres ellenőrzés az anamnesztikus adatok alapján, terhesség gyanúja esetén laboratóriumi vizsgálattal
11.3.5. Életvitel módja (fertőzésveszély, tájékoztatás a fertőzés megelőzés módjairól)
11.3.6. Labor: rutin
11.4. A kezelés monitorizálásának ellenőrzése (kontrollvizsgálat)
11.4.1. 3 havonta: labor (WE, Fvs, CRP, ASAT, ALAT, GGT, Karb, Kreat, Na, K)
11.4.2. 3 havonta: aktivitási index (endoscopia nélküli Mayo subscore meghatározása és dokumentálása)
11.4.3. 6 havonta: mellkas RTG (tüdőgyulladás, TBC kizárása céljából)
11.5. Megjegyzés
11.5.1. Súlyos: Mayo score 9
11.5.2. Immunszuppresszív, immunmoduláns terápia: legalább 2 mg/ttkg, vagy intolerancia esetén a legmagasabb tolerálható dózisú AZA kezelés 3 hónapon át
11.5.3. Fenyegető colectomia esetén sebészeti konzílium szükséges
11.5.4. Legalább 2 mg/ttkg dózisú, vagy a legnagyobb tolerálható dózisú AZA mellett szisztémás szteroid igény 3 hónapon át (10 mg prednisolon equivalens szteroid dózis alatt Mayo≥9 és Mayo≥2 endoszkópos subscore)
11.5.5. Mayo score csökkenése minimum 3 ponttal
A biológiai terápia során az alkalmazott gyógyszerkészítmények alkalmazási előírásában és az egészségügyi szakellátás társadalombiztosítási finanszírozásának egyes kérdéseiről szóló 9/1993. (IV. 2.) NM rendelet 1/A. számú mellékletének vonatkozó indikációs pontjaiban foglaltakat egyaránt szükséges figyelembe venni. 12. A finanszírozási eljárásrend alkalmazásának hatását mérő minőségi indikátorok
12.1. A területre fordított közkiadások alakulása, monitorozása.
12.2. A finanszírozási algoritmus szerint kezelt betegek aránya.
13. A finanszírozás szempontjából lényeges finanszírozási kódok
13.1. A releváns BNO kódok
|
A |
B |
1 |
Kód |
Elnevezés |
2 |
K5180 |
Colitis ulcerosa egyéb |
3 |
K5190 |
Colitis ulcerosa k.m.n. |
13.2. A releváns ATC kódok
|
A |
B |
C |
D |
1 |
ATC kód |
Hatóanyag |
Kategória |
Megjegyzés |
2 |
A07EC01 |
szulfasalazin |
DMARD |
Betegségmódosító szerek |
3 |
A07EC02 |
mesalazin |
DMARD |
Betegségmódosító szerek |
4 |
L04AD01 |
ciklosporin |
DMARD |
Betegségmódosító szerek |
5 |
L04AX01 |
azathioprin |
DMARD |
Betegségmódosító szerek |
6 |
L04AB02 |
infliximab |
BRMD |
Biológiai terápia eszközei |
7 |
L04AB04 |
adalimumab |
BRMD |
Biológiai terápia eszközei |
8 |
H02AB01 |
betamethason |
Szteroid |
Szteroid gyógyszerek |
9 |
H02AB04 |
metilprednizolon |
Szteroid |
Szteroid gyógyszerek |
10 |
H02AB06 |
prednizolon |
Szteroid |
Szteroid gyógyszerek |
11 |
H02AB09 |
hidrokortizon |
Szteroid |
Szteroid gyógyszerek |
12 |
A07EA06 |
budesonid |
Szteroid |
Szteroid gyógyszerek |
14. Rövidítések:
ATC: Anatomical Therapeutic Chemical klasszifikáció
BNO: Betegségek nemzetközi osztályozása
”
15. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
A plakkos psoriasis diagnosztikájának és kezelésének finanszírozási eljárásrendje
1. Az eljárásrend tárgyát képező betegség, betegcsoport megnevezése
1.1. Plakkos psoriasis
2. A kórkép leírása
A psoriasis krónikus gyulladásos bőrbetegség, mely többnyire jól körülírt területen erythemas papulosus, plakkos elváltozással jár. Számos betegnél ízületi érintettség is diagnosztizálható. A betegség jellemzője, hogy a betegek jelentős része állandó kiterjedt bőrtünetektől szenved. Hasonlóan az AP-hoz, a betegek funkcionális képessége, életminősége, általános egészségi állapota rendkívül kedvezőtlen. Az európai országokban a megbetegedés az össznépesség mintegy 1,4-2%-át érinti.
2.1. Autoimmun gyulladásos bőrgyógyászati betegségek: psoriasis
A psoriasis kezelését alapvetően a bőrtünetek kiterjedtsége, lokalizációja és jellege, illetve az egyéb kísérő tünetek (arthritis) jelenléte határozza meg. A kezelést elsősorban a rendelkezésre álló lokális, szisztémás és fototerápia jelenti. A kis kiterjedésű betegség esetén (a testfelület kevesebb, mint 10%-a) a lokális kezelés preferálható. A nagyobb kiterjedésű psoriasisban (BSAI≥10, a testfelület több mint 10%-a) a fototerápia és a szisztémás kezelés (metotrexát, cyclosporin, retinoidok) alkalmazása kerül előtérbe. A súlyos szisztémás kezelésre nem reagáló, továbbra is aktív kórfolyamatokban, illetve azokban az esetekben, amikor intolerancia, illetve a beteg egészségi állapotát veszélyeztető súlyos mellékhatás miatt a standard szisztémás kezelés kontraindikált, biológiai terápia alkalmazása indokolt. A biológiai terápia standard kezeléssel szembeni hosszú távú veszélyei és előnyei jelenleg csak részben ismertek.
2.2. A plakkos psoriasis aktivitása
A biológiai terápia indikációjának felállításakor a betegség súlyosságát és az életminőségre gyakorolt hatását definiálni kell. A krónikus súlyos plakkos psoriasisban a szakmai irányelv a „psoriasis kiterjedési és súlyossági indexet” (PASI, értéke 0-72 között) javasolja a betegség súlyosságának megítélésére. Amennyiben a PASI nem meghatározható (pl. erythrodermiás vagy pustulosus psoriasis), az érintett „testfelszín százalékban kifejezett értéke” (BSA) a mérvadó. A 10% feletti érték súlyos betegségként definiálható. A „Bőrgyógyászati Életminőségi Index” (DLQI, értéke 0-30 között) a bőrbetegségek által okozott életminőségbeli eltérések mérésére alkalmas mérőszám, ahol a 10 feletti érték már igen kifejezett életminőségbeli romlást jelez.
2.3. A betegség aktivitásának meghatározása és dokumentálásának ellenőrzése
2.3.1. Klinikai tünetek súlyossága
2.3.2. PASI „psoriasis kiterjedési és súlyossági index” (értéke 0-72 között)
2.3.3. BSA „testfelszín százalékban kifejezett értéke” (súlyos 10% felett)
2.3.4. DLQI „Bőrgyógyászati Életminőségi Index” (értéke 0-30 között)
2.3.5. Ízületi érintettség esetén: DAS 28, BASDAI index meghatározása
2.4. A diagnózis kritériumainak rögzítése (BNO: L4003, L4004, L4005, L4090)
2.4.1. PASI, BSA, DLQI dokumentálása
2.4.2. Reumatológus konzílium dokumentálása ízületi érintettség esetén
2.4.3. Perifériás ízületi érintettség esetén: DAS28 aktivitási index dokumentálása
2.4.4. Axiális ízületi érintettség esetén: BASDAI index dokumentálása
3. Az ellátás igénybevételének finanszírozott szakmai rendje, finanszírozási algoritmusa
4. A plakkos psoriasis kezelése
Standard szisztémás kezelési módszerek alatt a következőket értjük: acitretin, ciclosporin, metotrexát, szűk spektrumú ultraibolya (UV) B, és psoralen + UVA fotokemoterápia. Standard kezelési módszerekre nem reagáló eset: nem kielégítő klinikai javulás (kevesebb mint 50%-os PASI vagy BSA javulás a kiindulási értékhez képest, és a DLQI kevesebb mint 5 pontos javulása) a következő kezelési módszerekkel végzett legalább 3 hónapig tartó terápiás dózisú kezelés után: cyclosporin 2,5-5,0 mg/tskg/nap, vagy metotrexát egyszer 15 mg/hét (max. 25-30 mg), vagy acitretin 25-50 mg/nap, vagy szűkspektrumú UVB vagy PUVA (klinikai javulás hiánya, gyors recidíva vagy a maximálisan ajánlott dózisok elérése - PUVA: 150-200 kezelés, UVB: 350 kezelés).
4.1. Biológiai terápia: indukciós kezelés súlyos, aktív plakkos psoriasisban
4.1.1. A kezelés előtt rögzíteni kell:
4.1.1.1. PASI „psoriasis kiterjedési és súlyossági indexet” (értéke 0-72 között)
4.1.1.2. BSA „testfelszín százalékban kifejezett értéke” erythrodermiás vagy pustulosus psoriasis esetén
4.1.1.3. DLQI „Bőrgyógyászati Életminőségi Index” (értéke 0-30 között)
4.2. TNF-alfa vagy interleukin-inhibitor gátló terápia felnőttkori súlyos plakkos psoriasisban javasolt, amennyiben az alábbi kritériumok együttesen teljesülnek:
4.2.1. súlyos psoriasis fennállása esetén, amennyiben a teljes PASI nagyobb, mint 15 és a DLQI nagyobb, mint 10, és
4.2.2. legalább 3 hónapig tartó, standard szisztémás kezelés (metotrexát, cyclosporin, retinoid és PUVA) ellenére a betegség továbbra is súlyos, azaz PASI nagyobb, mint 15 és a DLQI nagyobb, mint 10, vagy a szisztémás kezeléssel szemben dokumentált intolerancia vagy kontraindikáció áll fenn.
4.3. Az anti-TNF-alfa és az interleukin-inhibitor indukciós kezelés hatékonyságának ellenőrzése plakkos psoriasis kezelésében
A kezelés 12-16. hetében meg kell határozni a PASI index összetevőit. Amennyiben a 12-16. hétre nem következik be PASI érték 50%-os javulása, illetve a DLQI 5 pontos, vagy annál nagyobb mérvű csökkenése, vagy súlyos mellékhatások lépnek fel, az elsőként választott biológiai kezelést le kell állítani. Bármely biológiai készítménnyel történő kezelés leállítása esetén másik biológiai válaszmódosító szer alkalmazása megkísérelhető, amennyiben egyéb kontraindikáció nem áll fenn.
4.4. Fenntartó kezelés plakkos psoriasis biológiai kezelésében
A kezelés további folytatásának eldöntése céljából háromhavonta rögzíteni kell:
4.4.1. PASI „psoriasis kiterjedési és súlyossági index” (értéke 0-72 között)
4.4.2. BSA „testfelszín százalékban kifejezett értéke” erythrodermiás vagy pustulosus psoriasis esetén
4.4.3. DLQI „Bőrgyógyászati Életminőségi Index” (értéke 0-30 között)
4.4.4. Folyamatos egy éven túli kezelés alatt álló betegek esetén a betegség súlyosságát legkésőbb 12 havonta újra szükséges értékelni, tartós (legalább 6 hónapja tartó) stabil remisszió esetén a dózis csökkentése lehetséges, a kezelés felfüggeszthető.
4.5. Az anti-TNF-alfa és az interleukin-inhibitor kezelés további folytatásának kritériumai
4.5.1. Amennyiben 3 hónapos indukciós kezelést követően a megfelelő hatásossági kritériumok nem teljesülnek, másik anti-TNF-α vagy IL inhibitor terápiára történő váltás (switch) megengedett.
4.5.2. Az anti-TNF-α terápia nem folytatható, amennyiben anti-TNF-α terápia ellenére 6 hónap alatt megfelelő terápiás válasz nem volt elérhető: primer hatástalanság.
4.5.3. Anti-TNF-α kezelés során a terápiás válasz elvesztése után, vagy intolerancia esetén másik szerre való váltás megengedett: szekunder hatástalanság.
4.5.4. Az anti-TNF-α terápia dózisának emelése a forgalomba hozatali engedélyben induló dózishoz képest nem javasolt.
4.5.5. A kijelölt intézmények szakavatott és a biológiai terápia alkalmazásában jártas bőrgyógyász szakorvosainak a kompetenciája az anti-TNF-α és IL-inibitor terápia indikálása és alkalmazása.
4.5.6. Az interleukin-inhibitor terápia társadalombiztosítási támogatással történő alkalmazása az anti-TNF-α terápia alkalmazásának feltételeivel azonos.
4.6. Biológiai terápiát megelőzően elvégzendő vizsgálatok
4.6.1. Teljes vérkép
4.6.2. Vizelet
4.6.3. Elektrolitok
4.6.4. Májfunkciós értékek
4.6.5. Vesefunkció
4.6.6. Antinukleáris antitestek
4.6.7. Anti-DNS
4.6.8. VVT-süllyedés, CRP
4.6.9. Hepatitis B és C vírus szerológia (esetleg hepatitis E)
4.6.10. HIV teszt
4.6.11. Terhességi teszt nőknél
4.6.12. Kétirányú mellkasröntgen, vagy Mantoux próba (kérdéses esetben pulmonológus konzílium)
4.6.13. Testsúly/testmagasság
5. Szövődmények monitorozása, ellenőrzése TNF-alfa gátló és interleukin-inhibitor kezelés alkalmazása esetén
5.1. Opportunista infekciók
5.1.1. Szisztémás fertőzésre utaló állapot gondos kivizsgálást igényel, az egyéni rizikófaktorok felmérésével és figyelembevételével.
5.1.2. Különös gondot kell fordítani a
5.1.2.1. tuberculosis kizárására (mellkas röntgen),
5.1.2.2. a fizikális vizsgálatra,
5.1.2.3. kétes esetben pulmonológiai vagy egyéb társszakmai konzíliumra. Ha fennáll a látens TBC veszélye, gátlószeres kezelés mellett adható a biológiai kezelés.
5.1.3. A kezelés időtartama alatt félévente-évente mellkas röntgen szükséges.
5.1.4. A biológiai terápia kezdetekor a latens és aktiv tuberculosis felismeréséhez szükséges vizsgálatokról, illetve a biológiai kezelés során a tuberculosis monitorizálásáról a szakmai irányelvek rendelkeznek.
5.1.5. Krónikus vírushepatitis sem jelent abszolút kontraindikációt, de különös körültekintéssel és az antivirális gátlószeres kezelés párhuzamos alkalmazásának indikálása miatt hepatológus szakember közreműködésével ajánlott.
5.2. Malignus betegségek
5.2.1. Malignus és lymphoproliferatív betegség kialakulásának kockázata fokozott.
5.2.2. Az egyébként igen ritkán előforduló, hepatosplenicus T-sejt lymphoma esetén az anti-TNF-alfa készítményt azathioprinnel együttesen alkalmazták.
5.3. Neurológiai eltérések
5.3.1. Nervus opticus neuritis
5.3.2. Demyelinizációs kórképek
5.4. Egyéb mellékhatások
5.4.1. Infúziós/injekciós helyi reakciókkal kell számolni.
5.4.2. Autoantitestek főleg a kiméra infliximab esetén alakulnak ki (9-17%), de humán készítmény ellen is termelődik autoantitest (0,7-2,6%).
A biológiai terápia során az alkalmazott gyógyszerkészítmények alkalmazási előírásában és az egészségügyi szakellátás társadalombiztosítási finanszírozásának egyes kérdéseiről szóló 9/1993. (IV. 2.) NM rendelet 1/A. számú mellékletének vonatkozó indikációs pontjaiban foglaltakat egyaránt szükséges figyelembe venni. 6. A finanszírozás szakmai ellenőrzésének alapját képező ellenőrzési sarokpontok
6.1. Adminisztratív ellenőrzési pontok (folyamatba épített ellenőrzés)
6.1.1. Kompetencia szint: kijelölt intézmény, eszközellátottság (UV), szakorvosi kompetencia
6.1.2. Betegadatok (online TAJ ellenőrzés)
6.1.3. Jogszabályban rögzített indikációs terület BNO ellenőrzése
6.2. Szakmai ellenőrzési pontok
6.2.1. A diagnózis kritériumainak rögzítése (BNO: L4003, L4004, L4005)
6.2.1.1. A betegség aktivitásának és súlyosságának dokumentálása
6.2.1.2. Klinikai tünetek súlyossága
6.2.1.3. PASI „psoriasis kiterjedési és súlyossági index” (értéke 0-72 között)
6.2.1.4. BSA „testfelszín százalékban kifejezett értéke” (súlyos 10% felett)
6.2.1.5. DLQI „Bőrgyógyászati Életminőségi Index” (értéke 0-30 között)
6.2.1.6. Reumatológus konzílium dokumentálása (ízületi érintettség esetén)
6.2.1.7. Perifériás ízületi érintettség esetén: DAS28 aktivitási index dokumentálása
6.2.1.8. Axiális ízületi érintettség esetén: BASDAI index dokumentálása
6.2.2. A biológiai terápia kontraindikációinak kizárása és ellenőrzése
6.2.2.1. TBC kizárása (mellkas RTG, esetleg Mantoux próba)
6.2.2.2. Fertőzések kizárása
6.2.2.3. Demyelinizációs betegség kizárása, autoimmun betegség (pl. SLE) kizárása
6.2.2.4. Terhesség kizárása
6.2.2.5. Szociális körülmény alkalmatlansága
6.2.2.6. Labor [rutin, immun (ANA, ANF)]
6.2.3. A kezelés monitorizálásának ellenőrzése (kontrollvizsgálat)
6.2.3.1. Indukciós kezelés alatt havonta: labor (We, FVS, CRP, ASAT, ALAT, GGT, Karb, Kreat, Na, K, vizelet)
6.2.3.2. Fenntartó kezelés alatt 1-3 havonta klinikai szituációtól függően: labor (We, FVS, CRP, ASAT, ALAT, GGT, Karb, Kreat, Na, K, vizelet)
6.2.3.3. Az indukciós kezelés hatásának felmérésére a kezelés 12-16. hetében, majd 3 havonta: aktivitási index (PASI, BSA, DLQI)
6.2.3.4. 6-12 havonta: mellkas RTG (tüdőgyulladás, TBC kizárása céljából)
6.2.3.5. Tartósan 1 éven túli kezelés esetén a kezelés felfüggesztésének lehetőségét vizsgálták-e
6.3. Megjegyzés
6.3.1. Standard szisztémás terápiák: immunmoduláns, immunszuppresszáns kezelések: metotrexát, cyclosporin A, terápiás dózisban
6.3.2. Retinoidok: acitretin
6.3.3. TNF-alfa gátlók: adalimumab, etanercept, infliximab (az alkalmazott támogatási kategória figyelembevételével)
6.3.4. Interleukin-inhibior: usztekinumab
7. A finanszírozási eljárásrend alkalmazásának hatását mérő minőségi indikátorok
7.1. A területre fordított közkiadások alakulása.
7.2. A finanszírozott algoritmus szerint kezelt betegek aránya.
8. A finanszírozás szempontjából lényeges finanszírozási kódok
8.1. Releváns BNO kódok
|
A |
B |
1 |
BNO |
BNO megnevezése |
2 |
L4050 |
Arthropathiás psoriasis (M07.0-M07.3*, M09.0*) |
3 |
L4003 |
Psoriasis vulgaris, kp.súlyos (PASI-SCORE 11-18) |
4 |
L4004 |
Psoriasis vulgaris, súlyos (PASI-SCORE 19-30) |
5 |
L4005 |
Psoriasis vulgaris, nagyon súlyos (PASI-SCORE 31-44) |
6 |
L4090 |
Psoriasis k.m.n. |
8.2. Releváns ATC kódok
|
A |
B |
C |
D |
1 |
ATC-kód |
Hatóanyag |
Kategória |
Megjegyzés |
2 |
L01BA01 |
metotrexát |
DMARD |
Betegségmódosító szerek |
3 |
L04AD01 |
ciklosporin |
DMARD |
Betegségmódosító szerek |
4 |
D05BB02 |
acitretin |
Retinoid |
Antipsoriatikus szisztémás szer |
5 |
L04AB01 |
etanercept |
BRMD |
Biológiai terápia eszközei |
6 |
L04AB02 |
infliximab |
BRMD |
Biológiai terápia eszközei |
7 |
L04AB04 |
adalimumab |
BRMD |
Biológiai terápia eszközei |
8 |
L04AC05 |
usztekinumab |
BRMD |
Biológiai terápia eszközei |
9. Fogalmak, rövidítések
ALAT Alanin-aminotranszferáz
ASAT Aszpartát-aminotranszferáz
ATC Anatomical Therapeutic Chemical klasszifikáció
BASDAI Bath Ankylosing Spondylitis Disease Activity Index
BNO Betegségek nemzetközi osztályozása
BSA Body surface area
CRP C-reaktív protein
DAS28 Disease Activity Score
DMARD Disease-modifying antirheumatic drugs
DLQI Dermatology Life Quality Index
FVS Fehérvérsejtszám szám
GGT Gamma-glutamil-transzferáz
K Kálium
Karb Karbamid-nitrogén
Kreat Kreatinin
Na Nátrium
PASI Psoriasis kiterjedési és súlyossági index
PUVA Psoralen + ultraviola sugárzás A
RTG Röntgen
SLE Szisztémás lupus erythematosus
TBC Tüdőtuberkolózis
TNF Tumor necrosis factor
tskg Testsúly kilogramm
UVA Ultraviola sugárzás A
UVB Ultraviola sugárzás B
We Vörösvértest-süllyedés
”
16. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
A rheumatoid arthritis diagnosztikájának és kezelésének finanszírozási eljárásrendje
1. Az eljárásrend tárgyát képező betegség, betegcsoport megnevezése
Rheumatoid arthritis (C00-C97)
2. A kórkép leírása
A rheumatoid arthritis (RA) krónikus, progresszív sokízületi gyulladással járó betegség. A betegség feltételezhetően autoimmun eredetű. A rheumatoid arthritis sújtotta betegek jelentős része állandó gyulladásos fájdalomtól szenved. A hagyományos betegségmódosító gyógyszerek a betegek jelentős részénél, főleg a hevesebb, súlyosabb eseteknél hatástalanok (non-responder, refrakter esetek). A magasabb gyulladásos aktivitás, a koraibb ízületi károsodás és a funkcionális kiesés, valamint az életminőség csökkenése szorosan összefüggenek. A rheumatoid arthritist nagyfokú gyulladás, következményes ízületi destrukció jellemzi. Kulcs-citokinjei a tumor-nekrózis faktor-alfa (TNF), interleukin-1, interleukin-6 és a RANK-ligand (RANKL). A biológiai terápia irányulhat a TNF gátlására, valamint célpontjai lehetnek a gyulladásos válaszban szereplő sejtek (T és B limfociták, antigén-prezentáló sejtek) felszíni markerei, amelyek blokkolása útján a T sejt aktiválódása (ko-stimuláció molekulái, CD28-CD80/CD86) meggátolható, illetve maga a sejt eliminálható (B sejt CD 20-marker).
2.1. A rheumatoid arthritis aktivitása
Az anatómiai károsodás a gyulladás következménye, a közvetlen cél ennek mérséklése. A gyulladás aktivitásának mérésére a napi gyakorlatban az Amerikai Reumatológus Társaság által összeállított „core set” szerint vizsgáljuk a duzzadt és nyomásérzékeny ízületek számát, az akut fázis proteinek termelődését jelző CRP-szintet vagy vörösvértest-süllyedést (a CRP érzékenyebb, de drágább), 10 cm-es VAS mérve a fájdalom intenzitását, valamint a beteg és az orvos globális véleményét a betegség aktivitásáról. Ezen paraméterek egy részéből egy összetett index, ún. betegség aktivitási score (DAS) képezhető.
A gyakorlatban a 28 ízület vizsgálatával nyert DAS 28-at alkalmazzuk. A DAS 28 esetében 3,2 alatt beszélünk mérsékelt, 3,2 és 5,1 között közepes és e felett magas gyulladásos aktivitásról. A bázisterápiás gyógyszerek adagjának titrálásával vagy több gyógyszer kombinálásával lehetőség szerint a DAS 28-at 3,2 alá kell szorítanunk. Az optimális eredmény természetesen a teljes remisszió elérése lenne, ez a DAS 28 esetében 2,6 alatti értéket jelent. A DAS szoros kontrolljával végzett, ez által irányított kezelés bizonyítottan eredményesebben mérsékli az anatómiai károsodás ütemét, mint a betegek hagyományos gondozása.
3. Az ellátás igénybevételének finanszírozott szakmai rendje, finanszírozási algoritmusa
4. A rheumatoid arthritis gyógyszeres kezelési algoritmusa
Az algoritmus általánosságban mindegyik arthritis típusban alkalmazható, a speciális szempontok figyelembevételével.
4.1. Tüneti kezelés (analgetikum, NSAID) (alapellátás + mindhárom progresszivitási szint)
4.2. Kezdeti szteroid kezelés (6 hónapig adható, lásd alább) (mindhárom reumatológiai szint)
4.2.1. ilyenkor betegségmódosító hatása van
4.2.2. infekció, szeptikus arthritis kizárása szükséges
4.3. Korai betegségmódosító terápia (mindhárom reumatológiai szint) optimálisan a folyamat első 3 hónapján belül
4.3.1. DMARD kombináció
4.3.1.1. a betegség aktivitásától függő DMARD kombináció
vagy
4.3.2. DMARD monoterápia
4.3.2.1. a methotrexat (MTX) az első választandó szer (kivétel: intolerancia, kontraindikációk)
4.3.2.2. ritka (mérsékelt aktivitás) esetben SSZ, chloroquin (CQ) is alkalmazható
4.3.2.3. MTX ineffektivitás, intolerancia esetén SSZ, LEF (LEF)
4.3.2.4. cyclosporin A (CsA), CQ, AZA
4.3.2.5. speciális esetben (vasculitis) CPH
4.4. Biológiai terápia (2. és 3. reumatológiai szint: biológiai terápia alkalmazására kijelölt intézmények)
4.4.1. valamelyik TNF-gátló (infliximab, etanercept, adalimumab, golimumab, certolizumab-pegol)
4.4.2. interleukin-6 receptor gátló (tocilizumab)
4.4.3. CTLA-4 analóg (abatacept)
4.4.4. 3 hónapig alkalmazott teljes dózisú vagy tolerálható dózisú DMARD kombinációs kezelés hatástalansága esetén engedélyezett társadalombiztosítási támogatással
4.5. Autológ őssejttranszplantáció (opcionálisan, nem rutinszerű)
5. Rheumatoid arthritis biológiai kezelése
5.1. A biológiai terápia során az alkalmazott gyógyszerkészítmények alkalmazási előírásában és az egészségügyi szakellátás társadalombiztosítási finanszírozásának egyes kérdéseiről szóló 9/1993. (IV. 2.) NM rendelet 1/A. számú mellékletének vonatkozó indikációs pontjaiban foglaltakat egyaránt szükséges figyelembe venni. 5.2. Indukciós és fenntartó kezelés súlyos rheumatoid arthritis esetén
5.2.1. Újonnan diagnosztizált aktív rheumatoid arthritis esetén elsőként választandó a DMARD monoterápia, alkalmazása javasolt gyors dózisemeléssel a megfelelő klinikai hatás eléréséig, vagy kombinációs terápia (beleértve a methotrexátot és legalább egy másik DMARD készítményt és rövid idejű kortikoszteroidot együttesen) a tünetek megjelenésétől számítva a lehető legrövidebb időn belül (<3 hónap).
5.2.2. Súlyos, aktív rheumatoid arthritis esetén az anti-TNF-α terápia (infliximab, etanercept, adalimumab, golimumab, certolizumab pegol) vagy interleukin-6 receptor gátló (tocilizumab), CTLA-4 analóg (abatacept) terápia alkalmazható azon betegek számára, akiknél az alábbi kritériumok együttesen teljesülnek:
5.2.2.1. RA diagnózisa: több, mint 4 ACR kritérium együttesen van jelen az alábbiak közül legalább 3 hónapja:
5.2.2.1.1. Reggeli ízületi merevség (>1óra)
5.2.2.1.2. Három vagy több ízületi régió gyulladása
5.2.2.1.3. A kéz ízületeinek gyulladása legalább egy régióban
5.2.2.1.4. Szimmetrikus ízületi gyulladás
5.2.2.1.5. Rheumatoid csomók
5.2.2.1.6. Radiológiai elváltozások: eróziók, sávos dekalcifikáció a kézfelvételen
5.2.2.1.7. Rheumatoid faktor jelenléte a szérumban
5.2.2.2. 1 hónap eltéréssel legalább két alkalommal DAS 28 aktivitási index 5,1-nél nagyobb,
5.2.2.3. legalább 3 hónapig tartó DMARD kombinációban történő alkalmazás ellenére megfelelő terápiás válasz nem volt elérhető (DAS 28 aktivitási index 5,1-nél nagyobb),
5.2.2.4. a methotrexat (hacsak nem kontraindikált) alkalmazásra került a DMARD kombináció részeként,
5.2.2.5. a megfelelő DMARD kombinációs terápia ideje minimum 3 hónap, ebből legalább 2 hónap standard dózisban, hacsak a dózisemelés toxicitás miatt nem kivitelezhető.
5.2.3. Az indukciós anti-TNF-α terápiát követően legalább 3 havonta szükséges a DAS 28 index értékelése.
5.2.3.1. Folyamatos, egy éven túli kezelés alatt álló betegek esetén a betegség súlyosságát legkésőbb 12 havonta újra szükséges értékelni, tartós (legalább 6 hónapja tartó) stabil remisszió esetén a dózis csökkentése lehetséges, a kezelés felfüggeszthető. A biológiai terápia leépítése a hagyományos DMARD terápia folytatása mellett javasolt.
5.2.4. Amennyiben 3 hónapos indukciós kezelést követően a megfelelő hatásossági kritériumok nem teljesülnek (DAS 28 nem javult legalább 1,2 ponttal), másik anti-TNF-α terápiára történő váltás (switch), IL6 receptor gátló (tocilizumab), CTLA-4 analóg (abatacept) vagy B sejt gátló (rituximab) kezelés megengedett. Switch-et követően, hatástalanság esetén további TNF-α gátló szerre nem érdemes váltani.
5.2.5. Az anti-TNF-α terápia nem folytatható, amennyiben anti-TNF-α terápia ellenére 6 hónap alatt megfelelő terápiás válasz nem volt elérhető (DAS 28 nem javult legalább 1,2 ponttal): primer hatástalanság.
5.2.6. Anti-TNF-α kezelés során a terápiás válasz elvesztése után vagy intolerancia esetén másik szerre való váltás megengedett: szekunder hatástalanság.
5.2.7. Az interleukin-6 receptor gátló (tocilizumab) és a CTLA-4 analóg (abatacept) terápiák alkalmazásának feltételei megegyeznek az anti-TNF-α terápia alkalmazásának feltételeivel.
5.2.8. B sejt gátló (rituximab) terápia methotrexattal kombinálva azon súlyos, aktív rheumatoid arthritisben szenvedő betegek kezelésében javasolt, akiknél TNF-α terápiára nem alakult ki megfelelő terápiás válasz vagy intolerancia jelentkezett.
5.2.9. B sejt gátló (rituximab) terápia methotrexattal kombinálva mindaddig folytatandó, amíg a megfelelő terápiás válasz fennáll. A megfelelő válasz kritériuma a következő: a betegség aktivitási index (DAS 28) javulás legalább 1,2 a kiindulási értékhez képest. Fenntartó terápia minimum 6 hónap múlva alkalmazható ismételten.
5.2.10. Az RA kezelésében az anti-TNF-α terápia és az interleukin-6 receptor gátló terápiák dózisának emelése csak az alkalmazási előírásokban foglaltak szerint javasolt.
5.2.11. A kijelölt centrumban, RA kezelésében jártas, megfelelő tapasztalattal rendelkező reumatológus szakorvos kompetenciája az anti-TNF-α, az interleukin-6 receptor gátló és a B sejt gátló (rituximab) terápia indikálása és alkalmazása.
6. Szövődmények monitorozása, ellenőrzése TNF-α gátló kezelés és az interleukin-6 receptor gátló terápiák alkalmazása esetén
6.1. Opportunista infekciók
6.1.1. Szisztémás fertőzésre utaló állapot gondos kivizsgálást igényel.
6.1.2. Különös gondot kell fordítani
6.1.2.1. a tuberculosis kizárására (mellkas röntgen, Mantoux);
6.1.2.2. további, krónikus bakteriális infekció kizárására;
6.1.2.3. 5 éven belüli malignus betegség kizárására;
6.1.2.4. a fizikális vizsgálatra;
6.1.2.5. kétes esetben pulmonológiai vagy egyéb társszakmai konzíliumra. Ha fennáll a latens TBC veszélye, gátlószeres kezelés mellett adható az anti-TNF-α kezelés.
6.1.2.6. A kezelés időtartama alatt
6.1.2.6.1. félévente mellkas röntgen szükséges,
6.1.2.6.2. tuberculosis monitorizálása (latens TBC esetén),
6.1.2.6.3. hepatitis B szerológiai szűrés a kockázatos betegek esetében.
6.2. Krónikus vírushepatitis (HBV, HCV) sem jelent kontraindikációt, de különös körültekintéssel és az antivirális gátlószeres kezelés párhuzamos alkalmazásának indikálása miatt hepatológus szakember közreműködésével ajánlott.
6.3. Malignus betegségek
6.3.1. Malignus és lymphoproliferatív betegség kialakulásának kockázata fokozott.
6.3.2. Az egyébként igen ritkán előforduló, hepatosplenicus T-sejt lymphoma esetén az anti-TNF-alfa készítményt azathioprinnel együttesen alkalmazták.
6.4. Neurológiai eltérések
6.4.1. Nervus opticus neuritis
6.4.2. Demyelinizációs kórképek
6.5. Kardiális állapot
6.5.1. NYHA III-IV. stádiumú kardiális elégtelenség esetén biológiai terápia nem indítható. A kezelés során a kardiális elégtelenség monitorozása szükséges.
6.6. Graviditás
6.6.1. A beteg figyelmét fel kell hívni a teratogén kockázatra és ezért az effektív antikoncepció szükségességére.
6.7. Egyéb mellékhatások
6.7.1. Infúziós/injekciós helyi reakciókkal kell számolni.
6.7.2. Autoantitestek főleg a kiméra infliximab esetén alakulnak ki (9-17%), de humán készítmény ellen is termelődik autoantitest (0,7-2,6%).
7. A finanszírozási szakmai ellenőrzés alapját képező ellenőrzési sarokpontok
7.1. Adminisztratív ellenőrzési pontok (folyamatba épített ellenőrzés)
7.1.1. Kompetencia szint: kijelölt intézmény, szakorvosi kompetencia ellenőrzése
7.1.2. Betegadatok (online TAJ ellenőrzés)
7.1.3. Jogszabályban rögzített indikációs terület BNO ellenőrzése
7.2. Szakmai ellenőrzési pontok
7.2.1. A diagnózis kritériumainak rögzítése (BNO: M06.9)
7.2.2. 4 ACR kritérium együttes jelenléte az alábbiak közül:
7.2.2.1. Reggeli ízületi merevség (>1 óra)
7.2.2.2. Három vagy több ízületi régió gyulladása
7.2.2.3. A kéz ízületeinek gyulladása legalább egy régióban
7.2.2.4. Szimmetrikus ízületi gyulladás
7.2.2.5. Rheumatoid csomók
7.2.2.6. Radiológiai elváltozások: eróziók, sávos dekalcifikáció a kézfelvételen
7.2.2.7. Rheumatoid faktor jelenléte a szérumban (RF faktor) (Labor)
7.2.3. A betegség aktivitásának meghatározása (aktivitási index DAS 28) és dokumentálásának ellenőrzése
7.2.3.1. súlyos: 5,1 felett a DAS 28 aktivitási index (módosított Disease Activity Score)
7.2.3.2. középsúlyos: 5,1 és 3,2 között a DAS 28 aktivitási index
7.2.3.3. enyhe: 3,2 alatt a DAS 28 aktivitási index
7.2.4. A biológiai terápia kontraindikációinak kizárása és ellenőrzése
7.2.4.1. TBC kizárása (mellkas RTG)
7.2.4.2. Fertőzések kizárása
7.2.4.3. Malignus betegség kizárása
7.2.4.4. Demyelinizációs betegség, SLE kizárása anamnesztikus adatok, klinikum alapján
7.2.4.5. Terhesség kizárása
7.2.4.6. Kongesztív szívelégtelenség kizárása (NYHA III-IV.)
7.2.4.7. Labor (rutin, immun): (RF, anti-CCP, ANA)
7.2.5. A kezelés monitorizálásának ellenőrzése (kontrollvizsgálat)
7.2.5.1. Indukciós kezelés alatt havonta, fenntartó kezelés alatt 3 havonta: labor (We, Fvs, CRP opcionális, ASAT, ALAT, GGT, Karb, Kreat, Na, K)
7.2.5.2. 3 havonta: aktivitási index (DAS 28)
7.2.5.3. 6 havonta: mellkas RTG (tüdőgyulladás, TBC kizárása céljából)
7.2.5.4. Tartós, 1 éven túli kezelés esetén a kezelés felfüggesztésének lehetőségét vizsgálták-e?
7.2.6. Megjegyzés
7.2.6.1. Elfogadott DMARD terápiák: metothrexat (MTX), LEF (LEF), SSZ, cyclosporin. A CsA, chloroquin (CQ), AZA speciális esetben (vasculitis) CPH alkalmazásakor a forgalomba hozatali engedély indikációit szükséges figyelembe venni
7.2.6.2. Elfogadott DMARD kombinációk: bármely szakmailag elfogadott DMARD kombináció alkalmazható
7.2.6.3. TNF alfa gátlók: adalimumab, etanercept, infliximab (az alkalmazott támogatási kategória figyelembevételével), golimumab, certolizumab pegol
7.2.6.4. Interleukin-6 receptor gátló: tocilizumab
7.2.6.5. B sejt gátló: rituximab
7.2.6.6. CTLA-4 analóg: abatacept
8. A finanszírozási eljárásrend alkalmazásának hatását mérő minőségi indikátorok
8.1. A területre fordított közkiadások alakulása, monitorozása.
8.2. A finanszírozási algoritmus szerint kezelt betegek aránya.
9. A finanszírozás szempontjából lényeges finanszírozási kódok
9.1. Táblázat: Releváns BNO kódok
|
A |
B |
1 |
BNO |
BNO megnevezése |
2 |
M0500 |
Felty-syndroma |
3 |
M0510 |
Rheumatoid tüdőbetegség (J99.0*) |
4 |
M0520 |
Rheumatoid érgyulladás |
5 |
M0530 |
Rheumatoid arthritis más szervek és szervrendszerek érintettségével |
6 |
M0580 |
Egyéb seropositiv rheumatoid arthritis |
7 |
M0590 |
Seropositiv rheumatoid arthritis, k.m.n. |
8 |
M0600 |
Seronegativ rheumatoid arthritis |
9 |
M0610 |
Felnőttkori kezdetű Still-betegség |
10 |
M0630 |
Rheumatoid csomó |
11 |
M0640 |
Gyulladásos polyarthropathia |
12 |
M0620 |
Rheumatoid bursitis |
13 |
M0680 |
Egyéb, meghatározott rheumatoid arthritis |
14 |
M0690 |
Rheumatoid arthritis, k.m.n. |
9.2. Táblázat: Releváns ATC kódok
|
A |
B |
C |
D |
1 |
ATC kód |
Hatóanyag |
Kategória |
Megjegyzés |
2 |
A07EC01 |
sulfasalazin |
DMARD |
Betegségmódosító szerek |
3 |
L01BA01 |
metotrexát |
DMARD |
Betegségmódosító szerek |
4 |
L04AA13 |
LEF |
DMARD |
Betegségmódosító szerek |
5 |
L04AD01 |
ciklosporin |
DMARD |
Betegségmódosító szerek |
6 |
L04AX01 |
azathioprin |
DMARD |
Betegségmódosító szerek |
7 |
P01BA01 |
chloroquin |
DMARD |
Betegségmódosító szerek |
8 |
L04AB01 |
etanercept |
TNF alfa gátló |
Biológiai terápia eszközei |
9 |
L04AA24 |
abatacept |
CTLA-4 analóg |
Biológiai terápia eszközei |
10 |
L04AB02 |
infliximab |
TNF alfa gátló |
Biológiai terápia eszközei |
11 |
L04AB04 |
adalimumab |
TNF alfa gátló |
Biológiai terápia eszközei |
12 |
L04AB06 |
golimumab |
TNF alfa gátló |
Biológiai terápia eszközei |
13 |
L04AB05 |
certolizumab-pegol |
TNF alfa gátló |
Biológiai terápia eszközei |
14 |
L04AC07 |
tocilizumab |
IL-6 R gátló |
Biológiai terápia eszközei |
15 |
L01XC02 |
rituximab |
B sejt gátló |
Biológiai terápia eszközei |
16 |
M01A |
NSAID |
NSAID |
Nem szteroid gyulladáscsökkentő |
17 |
H02AB04 |
metilprednizolon |
Szteroid |
Szteroid gyógyszerek |
18 |
H02AB06 |
prednizolon |
Szteroid |
Szteroid gyógyszerek |
19 |
H02AB08 |
triamcinolon |
Szteroid |
Szteroid gyógyszerek |
10. Fogalmak, rövidítések
RA Rheumatoid arthritis
ATC Anatomical therapeutic chemical klasszifikáció
BNO Betegségek nemzetközi osztályozása
ACR American College of Rheumatology
DAS Disease activity score
VAS Vizuális analóg skála
DMARD Disease modifying antirheumatic drug
TNF Tumor nekrózis faktor
CRP C-reaktív protein
MTX Methotrexat
CsA ciklosporin A
LEF Leflunomid
SSZ Szulfaszalazin
CQ Chloroquin
CPH Cyclophosphamid
AZA Azathioprin
NSAID Non-steroid anti-inflammatory drug
”
17. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
A juvenilis idiopathias arthritis diagnosztikájának és kezelésének finanszírozási eljárásrendje
1. Az eljárásrend tárgyát képező betegség, betegcsoport megnevezése
Juvenilis idiopathias arthritis
2. A kórkép leírása
A 16 éves kor előtt kezdődő, legalább 6 hete fennálló, legalább 1 ízületet érintő, ismeretlen eredetű, vagyis egyéb okkal nem magyarázható ízületi gyulladás esetén beszélünk juvenilis idiopathiás arthritisről (JIA).
2.1. A betegség felosztása
2.1.1. Szisztémás forma
2.1.2. Oligoarticularis forma
2.1.3. Polyarticularis lefolyású forma – rheumatoid factor pozitív
2.1.4. Polyarticularis lefolyású forma – rheumatoid factor negatív
2.1.5. Arthritis psoriatica
2.1.6. Enthesitishez kapcsolódó arthritis
2.1.7. Nem besorolható
2.2. A főbb klinikai formák közül a polyarticularis JIA-ban (30%) 5 vagy több ízületet érintő, általában szimmetrikus polyarthritis (kéz és láb kisízületek, nyaki gerinc érintettsége) jelentkezik, az esetek egyharmadában rheumatoid faktor pozitivitással. A lány-fiú arány 3:1. Az oligoarticularis JIA (50%) általában az alsó végtagok nagyízületeit (típusosan térdet, bokát) érintő, aszimmetrikus, rheumatoid faktor negatív oligoarthritis. Ebben a formában fordul elő leggyakrabban chronicus uveitis, különösen antinukleáris antitest jelenlétében. Leggyakrabban 1 és 4 éves kor között jelentkezik, lányoknál gyakoribb (4:1).
A szisztémás JIA (10%) lázzal, szisztémás tünetekkel (naponta visszatérő magas láz, tranziens erythemas maculosus kiütések, generalizált lymphadenopathia, hepatosplenomegalia, pericarditis) jár. A betegség extrém ritka 6 hónapos kor előtt, leggyakoribb 1-4 éves kor között, de bármely életkorban megjelenhet, fiúkat és lányokat egyenlő arányban érint.
A juvenilis arthritis psoriatica sokféle klinikai megjelenést mutathat, típusos a kis- és nagyízületeket aszimmetrikusan érintő oligo- vagy polyarthritis, a DIP ízületi érintettség, illetve a kolbászujj jelenség. Psoriasisos köröm jelenségek (Beau-pontok, onycholysis), illetve elsőfokú rokon psoriasisa a családi anamnézisben segít a diagnózis felállításában. Az enthesitishez kapcsolódó formában a betegek jelentős részénél sacroileitis alakul ki, esetenként gerinc érintettséggel, gyakori HLA-B27 asszociációval. A psoriasis itt kizáró kritérium.
2.3. A juvenilis idiopathias arthritis aktivitását Giannini javulási kritériumai szerint az alábbi paraméterek alapján értékeljük:
2.3.1. aktív ízületek száma
2.3.2. mozgáskorlátozott ízületek száma
2.3.3. az orvos általános értékelése a betegség aktivitásáról (VAS)
2.3.4. a beteg vagy a szülő / törvényes képviselő általános értékelése a betegség aktivitásáról (VAS)
2.3.5. CHAQ (Childhood Health Assessment Questionnaire)
2.3.6. We (mm/h)
3. Az ellátás igénybevételének finanszírozott szakmai rendje, finanszírozási algoritmusa
4. A juvenilis idiopathias arthritis gyógyszeres kezelési algoritmusa
A biológiai terápia során az alkalmazott gyógyszerkészítmények alkalmazási előírásában és az egészségügyi szakellátás társadalombiztosítási finanszírozásának egyes kérdéseiről szóló 9/1993. (IV. 2.) NM rendelet 1/A. számú mellékletének vonatkozó indikációs pontjaiban foglaltakat egyaránt szükséges figyelembe venni. 4.1. Szisztémás JIA (sJIA)
4.1.1. tüneti kezelés: analgetikum, NSAID
4.1.2. szteroid kezelés
4.1.3. infekció, szeptikus arthritis kizárása szükséges
4.1.4. biológiai terápia: NSAID és szisztémás szteroid kezelés hatástalansága esetén: tocilizumab (2. és 3. reumatológiai szint: biológiai terápiás centrumok)
4.2. Polyarticularis lefolyású JIA (pJIA)
4.2.1. tüneti kezelés (analgetikum, NSAID) (alapellátás + mindhárom progresszivitási szint) (a folyamat kezdetén maximum 2-3 hónapig, illetve később fellángolás esetén rövid ideig)
4.2.2. szteroid kezelés (mindhárom reumatológiai szint)
4.2.3. betegségmódosító terápia (mindhárom reumatológiai szint)
4.2.3.1. A methotrexat (MTX) az első választandó szer (kivétel: intolerancia). A forgalomba hozatali engedély indikációira különös figyelmet kell fordítani.
4.2.3.2. Ritka (nagyon enyhe) esetben szulfaszalazinnal (SSZ) is indíthatunk. A forgalomba hozatali engedély indikációira különös figyelmet kell fordítani.
4.2.4 Betegségmódosító terápia hatástalansága esetén biológiai terápia (2. és 3. reumatológiai szint: biológiai terápiás centrumok) – TNF-alfa gátló (etanercept vagy adalimumab) vagy IL-6 receptor-antagonista (tocilizumab).
4.2.5. Legalább egy TNF-alfa gátló hatástalansága esetén CTLA-4 analóg (abatacept) (2. és 3. reumatológiai szint: biológiai terápiás centrumok).
4.3. Egyéb JIA alcsoportok
4.3.1. tüneti kezelés (analgetikum, NSAID)
4.3.2. szteroid kezelés
4.3.3. betegségmódosító terápia (DMARD: pl. MTX, SSZ, immunszuppresszánsok)
4.3.4. biológiai terápia (etanercept)
4.3.5. A kezelések alkalmazása a diagnosztizált egyes alcsoportok (enthesopathiás forma, fiatalkori arthritis psoriatica, egyéb alcsoportok) szerint történik. (Lsd. 3. pont folyamatábra)
5. Indukciós és fenntartó kezelés súlyos juvenilis idiopathias arthritis esetén
5.1. Juvenilis idiopathias arthritis esetén biológiai terápia (etanercept, adalimumab vagy tocilizumab) indítható, ha a betegség poliartikuláris formája áll fenn, és a beteg legalább 3 hónapig adott 15 mg/m2/hét methotrexát kezelés ellenére aktív, azaz 5 vagy több ízület duzzadt és 3 vagy több ízület mozgáskorlátozott, fájdalmas, érzékeny, illetve a beteg állapota 0,25 mg/kg/nap vagy ennél nagyobb szteroid adag mellett is a fentiek szerint aktív. Indokolt a biológiai terápia akkor is, ha a felsorolt kezelések toxikusnak bizonyultak vagy nem tolerálhatók.
5.2. Biológiai terápia (tocilizumab) indítható a betegség szisztémás formájában, ha nem-szteroid gyulladásgátló vagy szisztémás szteroid adására nincs kellő terápiás válasz a szisztémás tünetek csökkenése (vörösvérsejt süllyedés, CRP, láz) és /vagy a Giannini kritériumok alapján.
5.3. Biológiai terápia indítható a juvenilis arthritis psoriatica (etanercept) és az enthesopathiás formák (etanercept vagy adalimumab) esetén is, ha az előbbi esetében methotrexatra, utóbbi esetében axiális érintettség esetén nem-szteroid gyulladásgátló kezelésre, perifériás tünetek esetén szulfaszalazinra nincs kielégítő terápiás válasz a Giannini kritériumok alapján a 3. hónapban esedékes értékeléskor.
5.4. Különös figyelemmel kell lenni minden esetben a készítmények alkalmazási előírásában szereplő indikációs területekre és az életkorra vonatkozó előírásokra. Biológiai terápia esetén a dózis emelése csak az alkalmazási előírásokban foglaltak szerint javasolt.
5.5. Csak a gyermekkori reumatológiai betegségek diagnosztizálásában és kezelésében jártas reumatológus szakorvosok kompetenciája a biológiai terápia indikálása és alkalmazása gyermekgyógyász konzíliárus bevonásával.
5.6. A Giannini javulási kritériumok összetevőit meg kell határozni a kezelés kontrollja során. Megfelelő válaszkészség esetén (Giannini javulási kritérium mértéke 30%-nál magasabb, vagyis legalább 3 paraméterben a javulás eléri a 30%-ot és csak egy paraméterben haladja meg a romlás a 30%-ot) az aktivitás rendszeres kontrollja mellett a remisszió fennállásáig folytatható a terápia.
5.7. Az sJIA tocilizumab kezelésénél az általános klinikai tüneteket is figyelembe kell venni (Giannini kritériumok mellett láz hiánya, gyulladásos laborparaméterek normalizálódása).
Folyamatos, egy éven túli kezelés alatt álló betegek esetén a betegség súlyosságát legkésőbb 12 havonta újra szükséges értékelni, tartós (legalább 6 hónapja tartó) stabil remisszió esetén a dózis csökkentése lehetséges, a kezelés felfüggeszthető.
5.8. A 18. életév betöltése után, amennyiben a betegség lefolyása kimeríti bármely felnőttkori krónikus arthritis klasszifikációját, a felnőttkori besorolás alkalmazandó és a diagnózis módosítandó.
6. Szövődmények monitorozása, ellenőrzése
6.1. Opportunista infekciók
6.1.1. Szisztémás fertőzésre utaló állapot gondos kivizsgálást igényel.
6.1.2. Különös gondot kell fordítani
6.1.2.1. a tuberculosis kizárására a kezelés megkezdése előtt és a kezelés időtartama alatt a szakmai irányelvben foglaltak szerint,
6.1.2.2. a fizikális vizsgálatra,
6.1.2.3. kétes esetben pulmonológiai vagy egyéb társszakmai konzíliumra. Ha fennáll a latens TBC veszélye, gátlószeres kezelés mellett adható az anti-TNF-α kezelés.
6.2. Krónikus vírushepatitis (HBV, HCV) sem jelent kontraindikációt, de különös körültekintéssel és az antivirális gátlószeres kezelés párhuzamos alkalmazásának indikálása miatt hepatológus szakember közreműködésével ajánlott.
6.3. Malignus betegségek
6.3.1. malignus és lymphoproliferatív betegség kialakulásának kockázata fokozott,
6.3.2. az egyébként igen ritkán előforduló, hepatosplenicus T-sejt lymphoma esetén az anti-TNF-alfa készítményt azathioprinnel együttesen alkalmazták.
6.4. Neurológiai eltérések
6.4.1. Nervus opticus neuritis
6.4.2. Demyelinizációs kórképek
6.5. Egyéb mellékhatások
6.5.1. Infúziós/injekciós helyi reakciókkal kell számolni.
6.5.2. Autoantitestek, főleg a kiméra, infliximab esetén alakulnak ki (9-17%), de humán készítmény ellen is termelődik autoantitest (0,7-2,6%).
7. A finanszírozási szakmai ellenőrzés alapját képező ellenőrzési sarokpontok
7.1. Adminisztratív ellenőrzési pontok (folyamatba épített ellenőrzés)
7.1.1. Kompetencia szint: kijelölt intézmény, szakorvosi kompetencia ellenőrzése
7.1.2. Betegadatok (online TAJ ellenőrzés)
7.1.3. Jogszabályban rögzített indikációs terület BNO ellenőrzése
7.2. Szakmai ellenőrzési pontok
7.2.1. A diagnózis kritériumainak rögzítése (BNO: M08.0)
7.2.1.1. 16 éves kor alatt
7.2.1.2. legalább 1 ízület érintett
7.2.1.3. az ízületi gyulladás tünetei legalább 6 hete fennállnak
7.2.1.4. egyéb, ismerten ízületi gyulladást okozó betegség kizárható
7.2.1.5. a 7 alcsoport valamelyikének meghatározása
7.2.1.6. radiológiai elváltozások identifikálása vagy kizárása (RTG)
7.2.1.7. rheumatoid faktor jelenléte a szérumban (RF faktor) (egyéb labor)
7.2.2. A betegség aktivitásának meghatározása (Giannini kritériumok) és dokumentálásának ellenőrzése
7.2.2.1. az orvos véleménye a betegségről (vizuális analóg skálával, VAS)
7.2.2.2. a beteg vagy szülő / törvényes képviselő véleménye a beteg állapotáról (VAS)
7.2.2.3. a gyermekkorra adaptált Health Assessment Questionnaire (CHAQ) értéke
7.2.2.4. a gyulladt ízületek száma
7.2.2.5. a mozgáskorlátozott ízületek száma
7.2.2.6. vörösvértest-süllyedés, illetve CRP
7.2.3. A biológiai terápia kontraindikációinak kizárása és ellenőrzése
7.2.3.1. TBC kizárása
7.2.3.2. fertőzések kizárása
7.2.3.3. demyelinizációs betegség, SLE kizárása az anamnesis és klinikum alapján
7.2.3.4. labor (rutin, immun: RF, anti-CCP, ANA)
7.2.4. A kezelés monitorizálásának ellenőrzése (kontrollvizsgálat)
7.2.4.1. havonta: labor (Wgr, Fvs, CRP opcionális, ASAT, ALAT, GGT, Karb, Kreat, Na, K)
7.2.4.2. 3 havonta: aktivitási index (Giannini)
7.2.4.3. TBC kizárása
7.2.4.4. tartós, 1 éven túli kezelés esetén a kezelés felfüggesztésének lehetőségét vizsgálták-e?
7.2.5. Megjegyzés
7.2.5.1. Elfogadott DMARD terápiák esetén a forgalomba hozatali engedély indikációira különös figyelmet kell fordítani.
7.2.5.2. TNF alfa gátlók: etanercept, adalimumab.
7.2.5.3. IL-6 receptor antagonista: tocilizumab.
7.2.5.4. Giannini 30% javulás: értékelhető javulásról akkor beszélünk, ha legalább 3 paraméterben a javulás eléri a 30%-ot és csak egy paraméterben haladhatja meg a romlás a 30%-ot.
8. A finanszírozási eljárásrend alkalmazásának hatását mérő minőségi indikátorok
8.1. A területre fordított közkiadások alakulása.
8.2. A finanszírozott algoritmus szerint kezelt betegek aránya.
9. A finanszírozás szempontjából lényeges finanszírozási kódok
9.1. Releváns BNO kódok
|
A |
B |
1 |
Kód |
BNO megnevezése |
2 |
M0800 |
Fiatalkori reumás ízületi gyulladás |
3 |
M0810 |
Fiatalkori spondylitis ankylopoetica |
4 |
M0820 |
Szisztémás kezdetű juvenilis arthritis |
5 |
M0830 |
Fiatalkori seronegativ polyarthritis |
6 |
M0840 |
Kevés ízületet érintő fiatalkori ízületi gyulladás |
7 |
M0880 |
Egyéb fiatalkori ízületi gyulladás |
8 |
M0890 |
Fiatalkori ízületi gyulladás, k.m.n. |
9 |
M0900 |
Fiatalkori ízületi gyulladás psoriasisban |
9.2. Releváns ATC kódok
|
A |
B |
C |
D |
1 |
ATC kód |
Hatóanyag |
Kategória |
Megjegyzés |
2 |
A07EC01 |
sulfasalazin |
DMARD |
Betegségmódosító szerek |
3 |
L01BA01 |
metotrexát |
DMARD |
Betegségmódosító szerek |
4 |
L04AA13 |
leflunomid |
DMARD |
Betegségmódosító szerek |
5 |
L04AD01 |
ciklosporin |
DMARD |
Betegségmódosító szerek |
6 |
L04AX01 |
azathioprin |
DMARD |
Betegségmódosító szerek |
7 |
P01BA01 |
chloroquin |
DMARD |
Betegségmódosító szerek |
8 |
L04AB01 |
etanercept |
TNF-alfa gátló |
Biológiai terápia eszközei |
9 |
L04AA24 |
abatacept |
CTLA-4 analóg |
Biológiai terápia eszközei |
10 |
L04AB04 |
adalimumab |
TNF-alfa gátló |
Biológiai terápia eszközei |
11 |
L04AC07 |
tocilizumab |
IL-6 RA |
Biológiai terápia eszközei |
12 |
M01A |
NSAID |
NSAID |
Nem szteroid gyulladáscsökkentő |
13 |
H02AB04 |
metilprednizolon |
Szteroid |
Szteroid gyógyszerek |
14 |
H02AB06 |
prednizolon |
Szteroid |
Szteroid gyógyszerek |
15 |
H02AB08 |
triamcinolon |
Szteroid |
Szteroid gyógyszerek |
10. Fogalmak, rövidítések
|
A |
B |
1 |
Rövidítés |
Megnevezés |
2 |
JIA |
Juvenilis idiopathiás arthritis |
3 |
ATC |
Anatomical therapeutic chemical klasszifikáció |
4 |
BNO |
Betegségek nemzetközi osztályozása |
5 |
VAS |
Vizuális analóg skála |
6 |
CHAQ |
Childhood health assessment questionnaire |
7 |
DMARD |
Disease modifying antirheumatic drug |
8 |
TNF |
Tumor nekrózis faktor |
9 |
CRP |
C-reaktív protein |
10 |
MTX |
Methotrexat |
11 |
SSZ |
Szulfaszalazin |
12 |
NSAID |
Non-steroid anti-inflammatory drug |
”
18. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
A spondylitis ankylopoetica diagnosztikájának és kezelésének finanszírozási eljárásrendje
1. Az eljárásrend tárgyát képező betegség, betegcsoport megnevezése
Spondylitis ankylopoetica
2. A kórkép leírása
2.1. A spondylitis ankylopoetica (SPA) meghatározás szerint a gerinc ízületeit érintő, ismeretlen eredetű, következményes elcsontosodással járó gyulladás. A gyulladás a tőízületeket, perifériás ízületeket és az íntapadási helyeket is érintheti. Jellemző a folyamatos, éjszaka fokozódó gerinc- (keresztcsonti, derék-, hát-, majd nyak-) fájdalom, a következményes ankylosis miatt a gerinc mozgásainak beszűkülése. Gerincérintettségen szimmetrikus sacroileitist és spondylitist értünk, perifériás formában a tőízületeken (csípő, váll) kívül a térdek, bokák, kézízületek érintettek leggyakrabban. Az extraskeletális tünetek közül a szem (anterior uveitis), szív-érrendszer (aortitis, aorta insufficientia, ingerületvezetési block), tüdő (kevert ventillációs zavar, felső lebeny fibrosis), amyloidosis emelhetők ki. Az örökletesség mértéke 72%, főleg a HLA-B27 génnek van jelentősége. A betegség férfiak között 4-5-ször gyakrabban fordul elő. A kezdet többnyire a 15-30 éves korra esik. Az esetek 70%-ában csak a gerinc és a tőízületek (sacroiliacalis ízületek, csípők) érintettek, 30%-ban perifériás érintettség (általában alsó végtagi mono- vagy oligoarthritis, enthesitis, illetve dactylitis) áll fenn. A betegség lefolyására jellemző, hogy viszonylag fiatal korban kezdődik és korán irreverzibilis ízületi károsodásokkal jár, melyek a tanulást, a szociális beilleszkedést és a munkavállalást is megnehezítik.
2.2. Az SPA terápiája elsősorban tüneti (NSAID, gyógytorna, pszicho-szociális támogatás). A biológiai terápia révén a tüneteket hatékonyan befolyásoló, a progressziót csökkentő, a betegség kimenetelét kedvezőbben befolyásoló kezelés áll rendelkezésre. A biológiai terápia csak azon betegek esetében kezdhető el, akiknél a módosított New York-i klasszifikációs kritériumok szerint a biztos diagnózis fennállása igazolt, radiológiailag legalább 2-es stádiumú bilaterális, vagy 3-as, 4-es stádiumú unilaterális sacroileitis, és legalább 3 hónapja háti fájdalom, frontális és sagittalis síkban beszűkült gerinc-, illetve beszűkült légzőmozgás áll fenn. A biológiai terápia elkezdésének további feltétele az adekvát gyógyszeres kezelés ellenére igazoltan fennálló aktív betegség. Adekvát gyógyszeres kezelésről akkor beszélhetünk, ha legalább két különböző, nem szteroid gyulladásgátló maximális vagy tolerálható dózisban történő, legalább 4 hétig tartó adagolása ellenére a betegség aktivitása nem csökken. Amennyiben a beteg fő panasza az SPA-hoz tartozó perifériás ízületi gyulladás, akkor további feltétel, hogy enthesitis, oligoarthritis esetében lokális vagy intraarticularis kortikoszteroid kezelés, polyarthritis esetében a rheumatoid arthritis kezelésében alkalmazott DMARD (elsősorban a szulfaszalazin megfontolandó szer) legalább négy hónapos gyógyszeres terápia ellenére is az aktív betegség fennálljon.
2.3. A betegség aktivitását a BASDAI index-szel határozzuk meg. Aktívnak tekinthető azon, SPA-ban szenvedő beteg, akinek a BASDAI indexe (0-100) több mint 40. A sacroiliacalis ízületek MR vizsgálata a betegség korai diagnózisának, tudományos vizsgálatokban az aktivitásának, a hagyományos RTG felvétel a betegség radiológiai progressziójának megítélését teszik lehetővé. Perifériás érintettségű SPA aktivitását a DAS 28 index-szel határozhatjuk meg.
2.4. A terápia további alkalmazásának eldöntése céljából a biológiai terápia hatásosságát és biztonságosságát rendszeresen ellenőrizni kell. A terápia hatásosnak tekinthető, amennyiben a megkezdett kezelést követő 12-14. hétre legalább 50%-os relatív BASDAI index csökkenés vagy az index 20 mm abszolút csökkenése igazolható. Amennyiben ez a feltétel nem teljesül, akkor a biológiai terápiát az adott készítménnyel nem lehet tovább folytatni. A BASDAI indexet a kezelés folyamán két-három havonta szükséges ellenőrizni. Ha legalább két egymást követő alkalommal az eredmény a 12-14. héten elért javuláshoz képest romlik (az index érték emelkedik), a kezelést szintén meg kell szakítani.
3. Az ellátás igénybevételének finanszírozott szakmai rendje, finanszírozási algoritmusa
4. A finanszírozási eljárásrend részletezése
4.1. A spondylitis ankylopoetica gyógyszeres kezelési algoritmusa
A biológiai terápia során az alkalmazott gyógyszerkészítmények alkalmazási előírásában és az egészségügyi szakellátás társadalombiztosítási finanszírozásának egyes kérdéseiről szóló 9/1993. (IV. 2.) NM rendelet 1/A. számú mellékletének vonatkozó indikációs pontjaiban foglaltakat egyaránt szükséges figyelembe venni. 4.1.1. Tüneti kezelés (NSAID analgetikum) (alapellátás + mindhárom progresszivitási szint) tartósan vagy fellángolás esetén rövid ideig
4.2. Perifériás érintettségű SPA
4.2.1. NSAID
4.2.2. Lokális, illetve szükség szerint intraarticularis szteroid kezelés (minimum 2 alkalommal) (mindhárom reumatológiai szint)
4.2.3. Infekció, szeptikus arthritis kizárása szükséges
4.2.4. Korai betegségmódosító terápia (mindhárom reumatológiai szint) (perifériás érintettség esetén jön szóba)
4.2.5. Optimálisan a folyamat első 3 hónapján belül
4.2.6. SSZ az elsőként javasolható szer (kivétel: intolerancia, kontraindikáció)
4.3. Axiális érintettségű SPA
4.3.1. NSAID készítmény alkalmazása, legalább 2 különböző készítmény maximális vagy tolerálható dózisban legalább 4 hétig
4.4. Biológiai terápia
4.4.1. Perifériás érintettségű súlyos SPA során DMARD (elsősorban szulfaszalazin) terápia, illetve súlyos axialis érintettségű SPA-ban alkalmazott legalább 2 NSAID hatástalansága esetén: biológiai terápia (2. és 3. reumatológiai szint: biológiai terápia alkalmazására kijelölt intézmény).
4.4.2. Valamelyik TNF-α gátló: infliximab (az alkalmazott támogatási kategória figyelembevételével), etanercept; adalimumab; golimumab.
4.5. Indukciós kezelés súlyos spondylitis ankylopoetica esetén
4.5.1. A kezelés előtt rögzíteni kell:
4.5.1.1. A BASDAI index összetevőit kétszer kell megmérni a kezelés előtt, legalább egyhónapos időközzel.
4.6. Az anti-TNF-α indukciós kezelés hatékonyságának ellenőrzése spondylitis ankylopoetica kezelésében
4.6.1. A kezelés 12-14. hetében meg kell határozni a BASDAI index összetevőit. Amennyiben a kiindulási értékhez képest legalább 50%-kal vagy 20 mm-rel nem javult az index átlaga, a biológiai terápia az adott készítménnyel nem folytatható. A BASDAI indexet a kezelés folytatása során legalább két-három havonta mérni kell.
4.6.2. Folyamatos, egy éven túli kezelés alatt álló betegek esetén a betegség súlyosságát legkésőbb 12 havonta újra szükséges értékelni, tartós (legalább 6 hónapja tartó) stabil remisszió esetén a dózis csökkentése lehetséges, a kezelés felfüggeszthető.
4.6.3. Csak szakavatott és a terápia alkalmazásában jártas, kijelölt intézmények szakorvosainak kompetenciája az anti-TNF-α terápia indikálása és alkalmazása.
5. Szövődmények monitorozása, ellenőrzése
5.1. Opportunista infekciók
5.1.1. Szisztémás fertőzésre utaló állapot gondos kivizsgálást igényel.
5.1.2. Különös gondot kell fordítani
5.1.2.1. a tuberculosis kizárására (mellkas röntgen, Mantoux),
5.1.2.2. a fizikális vizsgálatra,
5.1.2.3. kétes esetben pulmonológiai vagy egyéb társszakmai konzíliumra. Ha fennáll a latens TBC veszélye, gátlószeres kezelés mellett adható az anti-TNF-α kezelés.
5.1.3. A kezelés időtartama alatt félévente mellkas röntgen szükséges.
5.2. Krónikus vírushepatitis (HBV, HCV) sem jelent kontraindikációt, de különös körültekintéssel és az antivirális gátlószeres kezelés párhuzamos alkalmazásának indikálása miatt hepatológus szakember közreműködésével ajánlott.
5.3. Malignus betegségek
5.3.1. Malignus és lymphoproliferatív betegség kialakulásának kockázata fokozott.
5.3.2. Az egyébként igen ritkán előforduló, hepatosplenicus T-sejt lymphoma esetén az anti-TNF-alfa készítményt azathioprinnel együttesen alkalmazták.
5.3.3. Malignus folyamat esetén 10 éves túlélést követően kezdhető biológiai terápia. A bőr basaliomája esetén a várakozási idő 5 év.
5.4. Neurológiai betegségek (fennállásuk esetén a biológiai terápia kontraindikált)
5.4.1. Nervus opticus neuritis
5.4.2. Demyelinizációs kórképek
5.5. Kardiális állapot
5.5.1. NYHA III-IV. stádiumú kardiális elégtelenség esetén biológiai terápia nem indítható.
5.5.2. A kezelés során a kardiális elégtelenség monitorozása szükséges.
5.6. Graviditás
5.6.1. A beteg figyelmét fel kell hívni a teratogén kockázatra és ezért az effektív antikoncepció szükségességére.
5.7. Egyéb mellékhatások
5.7.1. Infúziós/injekciós helyi reakciókkal kell számolni.
5.7.2. Autoantitestek főleg a kiméra infliximab esetén alakulnak ki (9-17%), de humán készítmény ellen is termelődik autoantitest (0,7-2,6%).
6. Fenntartó kezelés spondylitis ankylopoetica biológiai kezelésében
6.1. A kezelés további folytatása során legalább két-három havonta rögzíteni kell a BASDAI indexet, amennyiben a paraméterek két egymást követő alkalommal sem érik el a 12-14. héten már elért legalább 20 mm-es csökkenést vagy 50%-os javulást (ami a folytatás feltétele), akkor a kezelést hatástalanság miatt abba kell hagyni.
7. Laboratóriumi vizsgálatok: célja az egyéb, a biológiai terápiákkal párhuzamosan felírt betegség-módosító gyógyszerek hatásvizsgálata.
7.1. Mielőtt megkezdjük a terápiát, vizsgálni kell:
7.1.1. teljes vérképet
7.1.2. vizeletet
7.1.3. elektrolitokat
7.1.4. májfunkciós értékeket
7.1.5. antinukleáris antitesteket (ANA)
7.1.6. anti-DNS-t
7.1.7. hepatitis szerológiát
8. A finanszírozási szakmai ellenőrzés alapját képező ellenőrzési sarokpontok
8.1. Adminisztratív ellenőrzési pontok (folyamatba épített ellenőrzés)
8.1.1. Kompetencia szint: kijelölt intézmény, szakorvosi kompetencia ellenőrzése
8.1.2. Betegadatok (online TAJ ellenőrzés)
8.1.3. Jogszabályban rögzített indikációs terület BNO ellenőrzése
8.2. Szakmai ellenőrzési pontok
8.2.1. A biológiai terápia elkezdéséhez szükséges kritériumok rögzítése (BNO: M45.H0)
8.2.1.1. 2-es stádiumú bilateralis vagy
8.2.1.2. 3-as, 4-es stádiumú unilateralis sacroiletitis (radiológiai vizsgálat)
8.2.1.3. legalább 3 hónapja mozgásra mérséklődő háti fájdalom
8.2.1.4. frontális (nem mérhető objektíven) és szagittális síkban beszűkült gerincmozgás
8.2.1.5. beszűkült légzőmozgás
8.2.2. A betegség aktivitásának meghatározása (BASDAI INDEX 0-100) és dokumentálásának ellenőrzése
8.2.2.1. BASDAI index (0-100) több, mint 40
8.2.2.2. klinikai tünetek súlyossága
8.2.2.3. akut fázis fehérjék magas szintje (laborvizsgálat)
8.2.2.4. gyors radiológiai progresszió (RTG felvétel)
8.2.2.5. gyulladásos aktivitás a gerinc és a sacroiliacalis ízületekben (MR felvétel opcionális)
8.2.2.6. tartós 1 éven túli kezelés esetén a kezelés felfüggesztésének lehetőségét vizsgálták-e?
9. A finanszírozási eljárásrend alkalmazásának hatását mérő minőségi indikátorok
9.1. A területre fordított közkiadások alakulása.
9.2. A finanszírozott algoritmus szerint kezelt betegek aránya.
10. A finanszírozás szempontjából lényeges finanszírozási kódok
10.1. Releváns BNO kódok
|
A |
B |
1 |
Kód |
BNO megnevezése |
2 |
M0810 |
Fiatalkori spondylitis ankylopoetica |
3 |
M45H0 |
Spondylitis ankylopoetica |
10.2. Releváns ATC kódok
|
A |
B |
C |
D |
1 |
ATC kód |
Hatóanyag |
Kategória |
Megjegyzés |
2 |
A07EC01 |
sulfasalazin |
DMARD |
Betegségmódosító szerek |
3 |
L04AB02 |
infliximab |
TNF-alfa gátló |
Biológiai terápia eszközei |
4 |
L04AB01 |
etanercept |
TNF-alfa gátló |
Biológiai terápia eszközei |
5 |
L04AB04 |
adalimumab |
TNF-alfa gátló |
Biológiai terápia eszközei |
6 |
L04AB06 |
golimumab |
TNF-alfa gátló |
Biológiai terápia eszközei |
7 |
M01A |
NSAID |
NSAID |
Nem szteroid gyulladáscsökkentő |
8 |
H02AB04 |
metilprednizolon |
Szteroid |
Szteroid gyógyszerek |
9 |
H02AB06 |
prednizolon |
Szteroid |
Szteroid gyógyszerek |
10 |
H02AB08 |
triamcinolon |
Szteroid |
Szteroid gyógyszerek |
11. Fogalmak, rövidítések
|
A |
B |
1 |
Rövidítés |
Megnevezés |
2 |
SPA |
Spondylitis ankylopoetica |
3 |
ATC |
Anatomical Therapeutic Chemical klasszifikáció |
4 |
BNO |
Betegségek nemzetközi osztályozása |
5 |
DAS |
Disease activity score |
6 |
BASDAI |
Bath ankylosing spondylitis disease activity index |
7 |
DMARD |
Disease modifying antirheumatic drug |
8 |
TNF |
Tumor nekrózis faktor |
9 |
SSZ |
Szulfaszalazin |
10 |
NSAID |
Non-steroid anti-inflammatory drug |
”
19. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
Az arthritis psoriatica diagnosztikájának és kezelésének finanszírozási eljárásrendje
1. Az eljárásrend tárgyát képező betegség, betegcsoport megnevezése
Arthritis psoriatica
2. A kórkép leírása
2.1. Az arthritis psoriatica (AP) egy krónikus szisztémás gyulladásos reumatológiai megbetegedés, mely a bőr psoriasisos elváltozásával társul. Az arthritis többnyire aszimmetrikus és jellemző a disztális interphalangeális ízületek érintettsége, az ujjak kolbászszerű duzzanata (dactylitis). A betegség bármely perifériás ízületet, a gerinc kisízületeit, a sacroiliacalis ízületeket és a szalagtapadási helyeket (enthesis) érintheti. Extraskeletalis érintettség (szem, szív-érrendszer, tüdő) előfordulhat. A kórkép diagnosztikája, kezelése és a betegség nyomon követése a bőrgyógyász és a reumatológus szakorvost egyaránt érinti. Az AP kórisméjét az elfogadott kritériumrendszerrel (Moll-Wright, CASPAR) igazolni kell.
2.2. Az arthritis psoriatica aktivitása
2.2.1. Az arthritis psoriaticában szenvedő beteg perifériás túlsúlyú arthritisének értékelésére a DAS 28 index, axiális érintettség aktivitásának mérésére a BASDAI index alkalmazható. A bőrérintettség kiterjedésének és súlyosságának értékelésére plakkos psoriasisban a PASI score elfogadott.
2.2.2. Axiális érintettség esetén a betegség aktivitását a BASDAI index-szel határozzuk meg. Aktív, súlyosnak tekinthető azon arthritis psoriaticában szenvedő beteg, akinek a BASDAI index (0-100) átlaga több mint 40, és az axiális érintettség fennállását radiológiai vizsgálatokkal igazolták. A sacroiliacalis ízületek MR vizsgálata a betegség aktivitásának, a hagyományos RTG felvétel a betegség radiológiai progressziójának megítélését teszik lehetővé.
2.2.3. Perifériás érintettség esetén a betegség aktivitását DAS 28 index-szel határozzuk meg. Súlyos, aktívnak tekinthető azon arthritis psoriaticában szenvedő beteg, akinek a DAS 28 értéke nagyobb, mint 5,1.
2.2.4. Bőrérintettség súlyosságának megítélésére a PASI index alkalmazható. A bőrtünetek kiterjedtsége, lokalizációja és jellege alapján enyhe vagy középsúlyos psoriasisról beszélünk, amennyiben a PASI<15. Nagyobb kiterjedésű elváltozásról akkor beszélünk, ha a PASI>15. Nagyon ritkán bőrtünet nélkül is előfordulhat arthritis psoriatica.
3. Az ellátás igénybevételének finanszírozott szakmai rendje, finanszírozási algoritmusa
4. Az arthritis psoriatica kezelése
4.1. A psoriasis kezelése a bőrgyógyász, az arthritis kezelése a reumatológus feladata, ezért az arthritis psoriatica kezelésében a két szakma képviselőinek együttműködése szükséges. Az arthritis psoriatica kezelése kezdetben nem-szteroid gyulladáscsökkentők, esetleg kis dózisú szteroid adása, ezek eredménytelensége esetén betegségmódosító gyógyszerek (DMARD) bevezetése. Ma perifériás érintettségű arthritis psoriaticában a methotrexat az első DMARD választás, a LEF, ciklosporin A (CsA) és SSZ is alkalmazható. (A forgalomba hozatali engedély indikációira különös figyelmet kell fordítani.)
4.2. A terápia további alkalmazásának eldöntése céljából a terápia hatásosságát rendszeresen ellenőrizni kell. A betegség jellegéből kifolyólag az érintettségtől függően a reumatológiában alkalmazott score-ok (axiális érintettség esetén BASDAI, perifériás érintettség esetén DAS 28) használhatóak a betegség súlyosságának megállapításához. Súlyos bőrérintettség esetén a PASI score felvétele elengedhetetlen, értékét a PASI mérésében gyakorlott személy (bőrgyógyász, de akár reumatológus vagy képzett asszisztens) állapíthatja meg.
4.3. Az arthritis psoriatica biológiai kezelése
A biológiai terápia során az alkalmazott gyógyszerkészítmények alkalmazási előírásában és az egészségügyi szakellátás társadalombiztosítási finanszírozásának egyes kérdéseiről szóló 9/1993. (IV. 2.) NM rendelet 1/A. számú mellékletének vonatkozó indikációs pontjaiban foglaltakat egyaránt szükséges figyelembe venni. 4.3.1. Indukciós kezelés súlyos, aktív arthritis psoriaticában
4.3.2. Axiális érintettség esetén a kezelés előtt rögzíteni kell:
4.3.2.1. A BASDAI index összetevőit kétszer kell megmérni a kezelés előtt, legalább egy hónapos időközzel.
4.3.3. Axiális érintettség esetén biológiai terápia indokolt, amennyiben
4.3.3.1. a Bath ankylosing spondylitis disease activity index (BASDAI) nagyobb, mint 40 és
4.3.3.2. súlyos bőrérintettség esetén a PASI nagyobb, mint 15
4.3.3.3. konvencionális, legalább 3 hónapig tartó, legalább 2 nonszteroid (NSAID) gyulladáscsökkentő terápia maximális vagy tolerálható dózisban történő alkalmazása ellenére a betegség aktivitásában megfelelő terápiás válasz nem volt elérhető.
4.3.4. Perifériás érintettség esetén a kezelés előtt rögzíteni kell:
4.3.4.1. a DAS 28 index összetevőit kétszer kell megmérni a kezelés előtt, legalább egy hónapos időközzel. A biológiai terápia indításakor a lemért paramétereket rögzíteni szükséges.
4.3.5. Perifériás érintettség esetén biológiai terápia indokolt, amennyiben:
4.3.5.1. a DAS 28 nagyobb, mint 5,1 és legalább 3 hónapig tartó, 2 konvencionális standard DMARD vagy legalább 3 hónapig tartó DMARD kombinációs terápia ellenére megfelelő javulás, aktivitáscsökkenés nem volt regisztrálható.
4.3.6. Súlyos bőrérintettség esetén a PASI index összetevőit kétszer kell megmérni a kezelés előtt, legalább egy hónapos időközzel. A biológiai terápia indításakor a lemért paramétereket rögzíteni szükséges.
4.3.7. Súlyos bőrérintettség esetén biológiai terápia indokolt, amennyiben:
4.3.7.1. súlyos bőrérintettség esetén (PASI nagyobb, mint 15) biológiai terápia bőrgyógyászati javallatra is indokolt a psoriasis finanszírozási eljárásrendje szerint. Amennyiben mind az ízületi aktivitás, mind a psoriasis kiterjedése és súlyossága alapján biológiai kezelés bevezetése indokolt, a reumatológus és a bőrgyógyász szakorvos dokumentált közös döntése alapján indul, majd követendő nyomon a biológiai kezelés.
4.4. Az anti-TNF-α indukciós kezelés hatékonyságának ellenőrzése arthritis psoriatica kezelésében
4.4.1. Axiális érintettség
4.4.1.1. A kezelés 14. hetében meg kell határozni a BASDAI index összetevőit. Amennyiben a kiindulási értékhez képest legalább 50%-kal vagy 20 mm-rel nem javult az index átlaga, a biológiai terápia nem folytatható.
4.4.2. Perifériás érintettség
4.4.2.1. A terápia hatásosságának értékelésére szintén a gyulladásos aktivitás objektív és nemzetközileg elfogadott mértékeként a DAS 28 rendszer alkalmazása javasolt. A válaszkészség mértékét az EULAR javulási kritériumai szerint kell meghatározni. A gyulladásos aktivitás értékelése és a mellékhatások regisztrálása háromhavonta szükséges.
4.4.2.2. Elsődleges hatástalanság: ha a TNF-α gátlás során a javulás a kezelés 3. hónapjában kisebb, mint 0,6 DAS 28 pont, a kezelés 6. hónapjában kisebb, mint 1,2 DAS 28 pont.
4.4.2.3. Másodlagos, „szerzett” rezisztencia: ha a korábban hatásos biológiai kezelés (a DAS 28 index csökkenése 3 hónap után minimum 0,6 és 6 hónap után minimum 1,2 pont) után az aktivitás ismét megemelkedik (a DAS 28 a kiindulási értékhez képest kevesebb, mint 1,2 ponttal alacsonyabb).
4.4.3. Súlyos bőrérintettség
4.4.3.1. A terápia hatásosságának értékelésére szintén a gyulladásos aktivitás objektív és nemzetközileg elfogadott mértékeként a PASI alkalmazása javasolt.
4.4.3.2. Nem megfelelő terápiás válaszról beszélünk akkor, ha a 12. hétre nem következik be PASI<15 vagy a PASI érték minimum relatív 50%-os javulása.
4.5. Fenntartó kezelés az arthritis psoriatica biológiai kezelésében
4.5.1. A kezelés további folytatásának eldöntése céljából háromhavonta rögzíteni kell a BASDAI (axiális érintettség esetén), DAS 28 (perifériás érintettség esetén), PASI (súlyos bőrérintettség esetén) indexeket. Folyamatos, egy éven túli kezelés alatt álló betegek esetén a betegség súlyosságát legkésőbb 12 havonta újra szükséges értékelni, tartós (legalább 6 hónapja tartó) stabil remisszió esetén a dózis csökkentése lehetséges, a kezelés felfüggeszthető.
4.6. Az anti-TNF-α kezelés további folytatásának kritériumai:
4.6.1. Amennyiben 3 hónapos indukciós kezelést követően a megfelelő hatásossági kritériumok nem teljesülnek, másik anti-TNF-α terápiára történő váltás (switch) megengedett.
4.6.2. Az anti-TNF-α terápia dózisának emelése a forgalomba hozatali engedélyben meghatározott induló dózishoz képest nem javasolt.
4.6.3. Csak szakavatott és a terápia-alkalmazásban jártas kijelölt intézmények szakorvosainak kompetenciája az anti-TNF-α terápia indikálása és alkalmazása.
4.7. Laboratóriumi vizsgálatok: célja az egyéb, a biológiai terápiákkal párhuzamosan felírt betegség-módosító gyógyszerek hatásvizsgálata. Mielőtt a terápia megkezdődik, vizsgálni kell:
4.7.1. We/CRP-t,
4.7.2. teljes vérképet,
4.7.3. vizeletet,
4.7.4. elektrolitokat,
4.7.5. májfunkciós értékeket,
4.7.6. antinukleáris antitesteket (ANA),
4.7.7. anti-DNS-t.
5. Szövődmények monitorozása, ellenőrzése
5.1. Opportunista infekciók
5.1.1. Szisztémás fertőzésre utaló állapot gondos kivizsgálást igényel.
5.1.2. Különös gondot kell fordítani
5.1.2.1. a tuberculosis kizárására (mellkas röntgen, Mantoux),
5.1.2.2. a fizikális vizsgálatra,
5.1.2.3. kétes esetben pulmonológiai vagy egyéb társszakmai konzíliumra. Ha fennáll a latens TBC veszélye, gátlószeres kezelés mellett adható az anti-TNF-α kezelés.
5.1.3. A kezelés időtartama alatt félévente mellkas röntgen szükséges.
5.2. Krónikus vírushepatitis (HBV, HCV) sem jelent kontraindikációt, de különös körültekintéssel, és az antivirális gátlószeres kezelés párhuzamos alkalmazásának indikálása miatt hepatológus szakember közreműködésével ajánlott.
5.3. Malignus betegségek
5.3.1. Malignus és lymphoproliferatív betegség kialakulásának kockázata fokozott.
5.3.2. Az egyébként igen ritkán előforduló, hepatosplenicus T-sejt lymphoma esetén az anti-TNF-alfa készítményt azathioprinnel együttesen alkalmazták.
5.4. Neurológiai eltérések
5.4.1. Nervus opticus neuritis
5.4.2. Demyelinizációs kórképek
5.5. Egyéb mellékhatások
5.5.1. Infúziós/injekciós helyi reakciókkal kell számolni.
5.5.2. Autoantitestek, főleg a kiméra infliximab esetén alakulnak ki (9-17%), de humán készítmény ellen is termelődik autoantitest (0,7-2,6%).
6. A finanszírozás szakmai ellenőrzésének alapját képező ellenőrzési sarokpontok
6.1. Adminisztratív ellenőrzési pontok (folyamatba épített ellenőrzés)
6.1.1. Kompetencia szint: intézményi, szakorvosi kompetencia ellenőrzése
6.1.2. Betegadatok (online TAJ ellenőrzés)
6.1.3. Jogszabályban rögzített indikációs terület BNO ellenőrzése
6.2. Szakmai ellenőrzési pontok
6.2.1. A diagnózis kritériumainak rögzítése (BNO: L40.5, M07.0-M07.3)
6.2.1.1. Moll-Wright vagy CASPAR kritériumok alapján
6.2.1.2. Perifériás érintettség: DAS 28 aktivitási index dokumentálása
6.2.1.3. Axiális érintettség: BASDAI index dokumentálása
6.2.1.4. Dermális érintettség: PASI index dokumentálása
6.2.2. A betegség aktivitásának meghatározása és dokumentálásának ellenőrzése
6.2.2.1. BASDAI index (0-100) átlaga több mint 40 (axiális érintettség esetén) vagy
6.2.2.2. DAS 28 index nagyobb mint 5,1 (perifériás érintettség esetén) vagy
6.2.2.3. PASI index nagyobb mint 15 (súlyos bőrérintettség esetén)
6.2.2.4. klinikai tünetek súlyossága
6.2.2.5. akut fázis fehérjék magas szintje (laborvizsgálat)
6.2.2.6. gyors radiológiai progresszió (RTG felvétel)
6.2.2.7. gyulladásos aktivitás a gerinc és a sacroiliacalis ízületekben (MR felvétel opcionálisan)
6.2.3. A biológiai terápia kontraindikációinak kizárása és ellenőrzése
6.2.3.1. TBC kizárása (mellkas RTG)
6.2.3.2. Fertőzések kizárása
6.2.3.3. Demyelinizációs betegség, SLE kizárása (anamnesztikus adatok és klinikum alapján)
6.2.3.4. Terhesség kizárása
6.2.3.5. Életvitel módja (fertőzésveszély)
6.2.3.6. NYHA III-IV. stádiumú szívelégtelenség
6.2.3.7. Malignus betegség 10 éven belül (kivéve basalioma: 5 éven belül)
6.2.3.8. Labor: rutin
6.2.4. A kezelés monitorizálásának ellenőrzése (kontrollvizsgálat)
6.2.4.1. Indukciós kezelés alatt havonta, fenntartó kezelés alatt 3 havonta: WE, CRP (opcionális), vérkép, GOT, GPT, GGT, CN, Kreat, ionok, vizelet vizsgálat javasolt
6.2.4.2. 3 havonta: aktivitási index (BASDAI vagy DAS 28 vagy PASI index meghatározása és dokumentálása)
6.2.4.3. 6 havonta: mellkas RTG (tüdőgyulladás, TBC kizárása céljából)
6.2.4.4. Tartós, 1 éven túli kezelés esetén a kezelés felfüggesztésének lehetőségét vizsgálták-e?
6.2.5. Megjegyzés
6.2.5.1. Elfogadott DMARD terápiák: methotrexat (MTX), LEF, SSZ, cyclosporin A (CsA), a készítmények forgalomba hozatali engedélyében szereplő indikációkat figyelembe kell venni
6.2.5.2. Elfogadott DMARD kombinációk: MTX intolerancia esetén bármely elfogadott DMARD kombináció alkalmazható
6.2.5.3. TNF alfa gátlók: adalimumab, etanercept, infliximab (az alkalmazott támogatási kategória figyelembevételével), golimumab
7. A finanszírozási eljárásrend alkalmazásának hatását mérő minőségi indikátorok
7.1. A területre fordított közkiadások alakulása, monitorozása.
7.2. A finanszírozott algoritmus szerint kezelt betegek aránya.
8. A finanszírozás szempontjából lényeges finanszírozási kódok
8.1. táblázat: Releváns BNO kódok
|
A |
B |
1 |
BNO |
BNO megnevezése |
2 |
M0700 |
Distalis interphalangealis ízületet érintő arthropathia psoriatica |
3 |
M0710 |
Arthritis mutilans (L40.5+) |
4 |
M0720 |
Spondylitis psoriatica (L40.5+) |
5 |
M0730 |
Egyéb psoriasisos arthropathiák (L40.5+) |
8.2. táblázat: Releváns ATC kódok
|
A |
B |
C |
D |
1 |
ATC kód |
Hatóanyag |
Kategória |
Megjegyzés |
2 |
A07EC01 |
sulfasalazin |
DMARD |
Betegségmódosító szerek |
3 |
L01BA01 |
metotrexát |
DMARD |
Betegségmódosító szerek |
4 |
L04AA13 |
LEF |
DMARD |
Betegségmódosító szerek |
5 |
L04AD01 |
ciklosporin |
DMARD |
Betegségmódosító szerek |
6 |
L04AB01 |
etanercept |
TNF-alfa gátló |
Biológiai terápia eszközei |
7 |
L04AB04 |
adalimumab |
TNF-alfa gátló |
Biológiai terápia eszközei |
8 |
L04AB02 |
infliximab |
TNF-alfa gátló |
Biológiai terápia eszközei |
9 |
L04AB06 |
golimumab |
TNF-alfa gátló |
Biológiai terápia eszközei |
10 |
M01A |
NSAID |
NSAID |
Nem szteroid gyulladáscsökkentő |
11 |
H02AB04 |
metilprednizolon |
Szteroid |
Szteroid gyógyszerek |
12 |
H02AB06 |
prednizolon |
Szteroid |
Szteroid gyógyszerek |
13 |
H02AB08 |
triamcinolon |
Szteroid |
Szteroid gyógyszerek |
9. Fogalmak, rövidítések
AP Arthritis psoriatica
ATC Anatomical therapeutic chemical klasszifikáció
BNO Betegségek nemzetközi osztályozása
EULAR European League Against Rheumatism
DAS Disease activity score
BASDAI Bath ankylosing spondylitis disease activity index
PASI Psoriasis area and severity index
DMARD Disease modifying antirheumatic drug
TNF Tumor nekrózis faktor
CRP C-reaktív protein
MTX Methotrexat
CsA Ciklosporin A
LEF Leflunomid
SSZ Szulfaszalazin
NSAID Non-steroid anti-inflammatory drug
”
20. melléklet az 59/2015. (XII. 30.) EMMI rendelethez
Oszteoporózis következtében kialakuló csonttörés primer prevenciójának finanszírozási eljárásrendje
1. Az eljárásrend tárgyát képező betegség, betegcsoport megnevezése
1.1. Oszteoporózis patológiás csonttörés nélkül (M81.0 – M81.9)
1.2. Oszteoporózis máshova osztályozott betegségekben (M82.0, M82.1, M82.8)
2. A kórkép leírása
2.1. Az oszteoporózis (csontritkulás) a csontváz generalizált, progresszív metabolikus megbetegedése, amelyben csontszövet szerves és szervetlen állományának arányos fogyása, ezáltal a csonttömeg megfogyatkozása, a csont finomszerkezetének károsodása és a csontminőség romlása a csont teherbíró képességének és rugalmasságának csökkenéséhez, fokozott törékenységhez vezet. Emiatt a csonttörések gyakoribbá válnak, mivel az oszteoporózisos csont eltörésének kockázata már kis erőbehatás esetén is fokozott. Az oszteoporózis következtében kialakult csípőtáji törés vagy combnyak-törés közvetlen életveszélyt jelenthet, de az egyéb csonttörések is jelentős mértékben ronthatják az életminőséget és fokozzák a mortalitást. A csonttörések idős korban egyre gyakoribbak, így jelentős népegészségügyi problémát és társadalmi költséget jelentenek. Nőknél, posztmenopauzában kezdetben a trabekuláris csontvesztés dominál, melyhez az életkor előrehaladtával kortikális csontvesztés társul.
2.2. Az oszteoporózis következtében fellépő csonttörések típusos helyei kezdetben:
2.2.1. a csigolyák és
2.2.2. az orsócsont disztális vége, majd idősebb korban válnak egyre gyakoribbá
2.2.3. a felkarcsont proximális törései és
2.2.4. a csípőtáji törések.
2.3. Ugyanakkor a klinikai gyakorlatban a csontváz bármely részén kis erőbehatásra bekövetkező csonttörés – lokalizációtól függetlenül – típusos oszteoporotikus törésnek minősül.
2.4. Legtöbbször a betegség involúciós (posztmenopauzális és szenilis) formáival találkozhatunk, de egyre nő a szekunder oszteoporózisok előfordulása is, amelyeket más szervek betegségei vagy gyógyszerek okoznak.
2.5. Az oszteoporózis népbetegség, az Európai Vertebralis Osteoporosis Tanulmány (EVOS) szerint hazánkban megközelítőleg 600 ezer nőt és 300 ezer férfit érint az 50 év feletti korosztályban. Más nemzetközi adatok szerint Európában az 50 éven felüli nők között 2-ből 1, a férfiak között 5-ből 1 szenved oszteoporózisban. A csontritkulás klinikai jelentőségét a kóros csonttörés és annak szövődményei adják, azon belül is a legnagyobb jelentőségűek a csípőtáji törések. Egyes felmérések szerint a csípőtáji töröttek több mint 30%-a a fraktúra utáni első évben meghal, mintegy fele élete végéig ellátási segítségre szorul, s csupán minden ötödik beteg gyógyul teljesen. A csigolyatörések zöme fokozatosan keletkezik, és sokáig rejtve marad, csupán az esetek tizede kerül azonnal észlelésre.
2.6. Az oszteoporózis terápiája alapvetően a törések megelőzésére irányul. Az oszteoporózis multifaktoriális betegség, de az egyes tényezők egymáshoz való viszonya még kevéssé tisztázott. Mind az oszteoporózis, mind az oszteoporózisos csonttörés kialakulásának kockázatát több tényező növelheti, egyes tényezők mindkettőt. A terápiát igénylő betegek a csonttörés rizikófaktorainak és a csont-denzitás meghatározása alapján azonosíthatóak be.
2.7. A legfontosabb validált törési rizikótényező az életkor. A 80 év feletti populációban történik a csonttörések 25%-a. A másik legfontosabb kockázati tényező a csökkent ásványi csonttömeg. Az oszteoporózis további legfontosabb rizikófaktorai a női nem, a kis testtömeg vagy 10%-nál több testtömeg elvesztése, tartós immobilizáció, korábbi oszteoporotikus csonttörés, oszteoporózisra pozitív családi anamnézis, kollagén keresztkötés magas szérum (vizelet) szintje, szteroidok tartós szedése, dohányzás, alkoholizmus, reumatoid arthritis. Ezek a rizikófaktorok nőknél a posztmenopauzás életszakaszban a legjelentősebbek, de nem egyformán hangsúlyosak.
2.8. Az oszetoporotikus törések kockázati tényezőit az alábbi táblázat foglalja össze.
2.8.1. Egy csigolya kompressziója (több mint 25%-os magasságcsökkenése)
2.8.2. Többszörös csigolyakompresszió
2.8.3. Bármilyen korábbi oszteoporotikus törés
2.8.4. 65 év feletti életkor
2.8.5. Szekunder hyperparathyreosishoz vezető kórképek
2.8.6. Hypogonadismus
2.8.7. Tartós (három hónapot meghaladó) oralis glükokortikoid (több mint napi 7,5 mg prednizolonnal ekvivalens) kezelés
2.8.8. Cushing szindróma
2.8.9. Szubklinikus hypercortisolismus
2.8.10. Primer hyperparathyreosis
2.8.11. Glitazon kezelés
2.8.12. Non-vertebrális törés 50 év felett
2.8.13. Aromatáz inhibitor kezelés
2.8.14. Androgéndeprivációs kezelés
2.8.15. Reumatoid arthritis
2.8.16. Spondylarthritis ankylopoetica
2.8.17. Proximális femurtörés a szülőknél
2.8.18. Soványság (BMI kevesebb mint 20 kg/m2)
2.8.19. Dohányzás
2.8.20. Többszörös esés
2.8.21. Immobilizáció
2.8.22. Epilepsia (antiepileptikus kezelés)
2.8.23. Gyomor-, bélresectio
2.8.24. Diabetes mellitus (1. és 2. típus)
2.8.25. TSH szintje alacsonyabb, mint 0,3 mU/l
2.8.26. Elesési kockázatot növelő gyógyszerek szedése (szedatívumok, antidepresszánsok, neuroleptikumok, orthostatist okozó gyógyszerek)
2.8.27. Kezeletlen korai (45 éves kor előtt kezdődő) menopauza
2.8.28. Minimum 4 egység alkohol fogyasztása naponta (1 alkohol egység 8-10 g alkoholt jelent, ami szeszes italban kifejezve 1 pohár sör, 1 dl bor, 2 cl rövidital)
2.8.29. Csípőtörés a szülői anamnézisben
2.8.30. Fokozott csontturnover
2.9. Az Egészségügyi Világszervezet (WHO) munkacsoportja validált kockázati tényezők alapján egy rizikóbecslő rendszert alakított ki, amely integrálja a páciens egyes kockázati tényezőivel kapcsolatos veszélyeztetettségét, és megadja az oszteoporotikus törés 10 éves valószínűségét. A FRAX® (Fracture Risk Assessment Tools) a combnyak BMD, a kor, a nem, a BMI, az előző törések, a családban korábban előfordult csípőcsont-törés, dohányzás, alkoholfogyasztás, glükokortikoid kezelés, rheumatoid arthritis, illetve szekunder osteoporosis megléte alapján ország specifikusan becsüli meg a rizikót. A FRAX-modellt több tízezer európai, amerikai, ázsiai és ausztrál beteg csont-sűrűségi és törési adatainak feldolgozásával fejlesztették ki. A számítógépes algoritmus az interneten bárki számára hozzáférhető (http://www.shef.ac.uk/FRAX), és az adott ország törési statisztikáinak felhasználásával kiszámítható az adott beteg törési kockázata. A FRAX a magyar betegek vonatkozásában hazai adatok alapján végzi a számítást.
2.10. Az oszteoporózis kezelésének és a kóros csonttörések megelőzésének alapja az elegendő kalcium és D-vitamin bevitel, továbbá a megfelelő mértékű fizikai aktivitás. Szükség esetén gyógyszeres terápiával lehet a csontritkulás folyamatát gátolni.
2.11. Primer prevenció alatt azon posztmenopauzás nők és 55 év feletti férfiak kezelése értendő, akiknek fokozott kockázatuk van kóros csonttörésre, és a gyógyszeres kezeléssel ez a kockázatuk csökkenthető.
2.12. Jelen finanszírozási eljárásrend a posztmenopauzás nők és 55 év feletti férfiak oszteoporózis miatt kialakuló csonttörésének primer megelőzését célzó kezelését határozza meg, nem foglalja magába a csontritkulást szűrő programokat.
3. Diagnosztika
3.1. Az ásványi csonttömeg denzitometriás módszerekkel pontosan megmérhető. A mért csontsűrűséget (BMD, bone mineral density, g/cm2) az egészséges fiatalok átlagértékéhez, a csúcs-csonttömeghez (PBM, peak bone mass) hasonlítják, és a különbséget a fiatal populáció normál értékének szórásában (SD) fejezik ki (T-score). Leggyakrabban az alacsony energiájú röntgensugárzással végzett képalkotó eljárást (DEXA; Dual Energy X-Ray Absorptiometry) használják. Ezen kívül alkalmazzák az ultrahangos csontsűrűség mérést és a kvantitatív komputertomográfiát is, az előbbi társadalombiztosítás által nem támogatott, utóbbit csak kutatásokhoz kapcsolódóan jelentik az engedéllyel rendelkező szolgáltatók. A javasolt mérési helyek elsősorban az ágyéki gerinc, csípőtájék, további lehetőség az alkar, sarok és kézujjak.
3.2. Az oszteoporózis diagnózis felállításának alapvető feltétele a T-score érték meghatározása. Az oszteoporózist azoknál jelenthetjük ki, akiknél ez az érték -2,5-nél kisebb. Az Egészségügyi Világszervezet ajánlása szerint az alábbi diagnosztikus kategóriákat állíthatjuk fel a T-score értéke alapján:
3.2.1. T-score nagyobb, mint –1,0 SD = egészséges csontozat
3.2.2. T-score –1,0 és –2,5 SD közötti = oszteopénia
3.2.3. T-score kisebb, mint –2,5 SD = oszteoporózis
3.2.4. T-score kisebb, mint –2,5 SD és legalább egy oszteoporózis miatti csonttörés = súlyos oszteoporózis
3.3. Oszteoporózis esetén a csontsűrűség törzscsontokon való mérését a társadalombiztosítás finanszírozza. A diagnosztikus eljárás a 3570C Csontsűrűség mérése törzscsontokon (törzsi csontok ásványianyag tartalmának fotonabsorptiós meghatározása) OENO kóddal jelenthető. A vizsgálat oszteoporózis esetén 12 havonta egyszer számolható el -2,5 vagy kisebb (rosszabb) T-score érték melletti specifikus törés prevenciós gyógyszeres kezelés esetén.
3.4. A végtagcsontokon történő csontsűrűség mérést a társadalombiztosítás kizárólag thyreotoxcosis és primer hyperparathyreosis esetén finanszírozza, melyet a közfinanszírozott szolgáltatók a 3570A Csontsűrűség mérése végtagcsontokon [bármely végtagcsont (alkar, sarok, tibia, stb.) ásványianyag tartalmának fotonabsorptiós meghatározása] OENO kóddal jelenthetnek.
3.5. A kvantitatív CT-vel történő csontsűrűség mérés közfinanszírozásba nem befogadott eljárás, de az engedélyezett orvosbiológiai kutatásokhoz kapcsolódóan a 3570D Csontsűrűség mérése pQCT-vel (végtagcsontok ásványianyag tartalmának meghatározása quantitativ computer tomographiával) OENO kódon jelenteni kell az Országos Egészségbiztosítási Pénztár felé.
3.6. A kezelőorvos számára a laboratóriumi vizsgálatok (Ca, P, PTH, D-vitamin, TSH) a csökkent BMD kóreredetének elkülönítésében, a csont-turnover markereinek (a reszorpció és formáció biomarkerei, elsősorban a szérum és vizelet kollagén keresztkötést tartalmazó peptidjeinek és csontspecifikus alkalikus foszfatáznak) a meghatározása a terápia-választásban segíthetnek.
4. Terápia
4.1. Kalcium és D-vitaminpótlás
4.1.1. A primer prevencióban az oszteoporózis kezelésének alapja az elegendő kalcium és D-vitamin bevitel, továbbá a megfelelő mértékű fizikai mozgás. Epidemiológiai vizsgálatok bizonyítják, hogy az adekvát kalcium- és D-vitamin bevitel gyermekeknél a csúcs-csonttömeg kialakulásában, időseknél a csontvesztés megelőzésében és a törési, illetve az esési kockázat csökkentésében játszik szerepet.
4.1.2. A fizikai aktivitás stimulálja az oszteoblasztokat, továbbá az izomerő javulásával az elesések száma is csökken. Preventív céllal, illetve oszteopénia eseteiben a rendszeres megfelelő intenzitású és frekvenciájú testedzés ajánlott. Ez a gyakorlatban minimum heti háromszori alkalommal végzett aerobik jellegű, ütközéssel járó mozgásformát jelent. A nagyobb csontmennyiség kialakulását elsősorban a pubertás kor előtt elkezdett fizikai aktivitás segíti elő a terhelésnek kitett csontokon.
4.1.3. Fontos prevenciós tényező az immobilizáció kerülése, az immobilitás megszüntetése lehetőség szerint 7 napon belül, továbbá az eséskockázat csökkentése. Ez utóbbi alatt elsősorban a beteg környezetének a botlások, elcsúszások elkerülése miatti akadálymentesítését, illetve fokozott esési kockázat esetén az egyéb (pl. esési kockázatokhoz vezető gyógyszeres kezelés) okok feltárását és életmódbeli változtatással annak elkerülését értjük (pl. megfelelő szemüveg viselése, altató korai bevételének kerülése, stb.). Az életkörülmények célszerű átalakítása önmagában 50%-kal csökkenti a törési kockázatot. Prevenciós hatása van még a napi minimum 30 perc szabad levegőn eltöltött időnek, napfény expozícióval, a megfelelő kalória-, kalcium-, B12 vitamin- és folsavbevitelnek, továbbá a dohányzás elhagyásának.
4.1.4. A megfelelő kalcium bevitel elengedhetetlenül fontos a normális növekedéshez, a maximális csúcs csonttömeg kialakulásához, valamint a felnőttkori csontanyagcsere egyensúlyának fenntartásához. A javasolt napi kalcium bevitel napi 1000 mg, de legfeljebb 1200 mg. A kalcium bevitel további fokozása káros következményekkel járhat, napi 2000 mg felett fokozódik a törések gyakorisága, férfiak esetében 1300-1500 mg felett fokozódik a prostata carcinoma incidenciája. Magyarországon egy felnőtt személy átlagos napi kalcium fogyasztása 400-600 mg közötti. Célszerű az ajánlott mennyiségeket étel formájában elfogyasztani, de ha természetes formában nem elégséges a kalcium bevitel, azt gyógyszeresen ki kell egészíteni. A gyógyszeres kalcium pótlásnál előnyben részesítendők a citrát sók. A citrát só előnye a pH-független felszívódás, a nagyobb biohasznosulás, a gastrointestinalis mellékhatások hiánya, illetve a citrát vizelettel történő ürülése során a kalcium vesekövesség elleni védelem. Meta-analízisek csökkent törési arányt mutattak ki olyan betegekben, akik legalább 80%-ban betartották a kalciumpótlás előírásait.
4.1.5. A D-vitaminhiány gyakorisága az életkor előrehaladtával párhuzamosan folyamatos növekedést mutat. A 65 év feletti lakosságnak legalább harmada D-vitaminhiányban szenved. Már a mérsékelt D-vitaminhiány csontritkulást okozhat. Kifejezett D-vitaminhiányról beszélünk, ha a szérum 25-OH-D-vitamin szint 12-15 ng/ml alatt van, idősek esetén azonban már a 25 ng/ml alatti érték is csontvesztéshez vezethet. Kimutatható, hogy a legalább napi 700-800 NE D-vitamin bevitele már segít megelőzni az idősebbek csípőtöréseit. Szakmai konszenzus alapján a megfelelő D-vitaminpótlás 800-2000 NE D3 vitamin naponta vagy ekvivalens dózisok hetente-többhetente. D-vitaminpótlás során rendszeresen kell ellenőrizni (1., 3., 6. hónapban, majd évente, illetve dózisváltáskor) a szérum kalcium szintjét és a vizelet kalciumürítést.
4.1.6. Kalcium és D-vitamin bevitel kiegészítő pótlása a társadalombiztosítás által akkor támogatott, ha a dokumentáltan gondozott posztmenopauzás nő vagy 55 év feletti férfi beteg oszteoporózisa igazolódott (BMD -2,5 SD T-score alatti), vagy nála a fokozott töréskockázati tényezőkből legalább három egyidejűleg bizonyítottan fennáll, vagy a FRAX alapján számított 10 éves törési kockázata magas (általános>20%, illetve csípő>3%). A szükséges kalcium és D-vitaminbevitel, amennyiben nincs ellenjavallata, az oszteoporózis terápiájának folyamatos követelménye, ugyanúgy a megfelelő életvitel kialakítása.
4.2. Biszfoszfonátok
4.2.1. A gyógyszeres terápia megválasztásánál fontos szempont, hogy a negatív csonthatások elkerülésére csak a valóban szükséges gyógyszerek szükséges és elegendő mennyiségű szedése történjen meg. A kezelés finanszírozási lépéseinek megválasztásánál az adott készítmény alkalmazási előiratát figyelembe kell venni.
4.2.2. A csontritkulás okozta kóros csonttörések primer és szekunder prevenciójában egyaránt az első választandó gyógyszerhatóanyag-csoport a biszfoszfonátok. A biszfoszfonátok erősen kötődnek a csontszövethez és gátolják az oszteoklasztok aktivitását, és azok apoptózisát okozzák, ezzel erősen gátolva a csontreszorpciót. A klinikai vizsgálatok bizonyítékai alapján, mind a vertebrális, mind a nem-vertebrális csonttöréseket csökkentő hatásuk miatt, első választandó szerként – megfelelő kalcium- és D-vitaminbevitel mellett – ajánlják az alendronátot, risedronátot és ibandronátot.
4.2.3. Az orális biszfoszfonátok kiváló klinikai hatása ellenére a betegek rövid- és hosszú távú együttműködési készsége is alacsonynak bizonyult, sokszor nem az előírás és az orvosi utasítás szerint szedik az orvosságot (rossz compliance), és elhagyják a krónikus betegségre rendelt, hosszú ideig szedendő gyógyszert (rossz perzisztencia).
4.2.4. Az együttműködést rontja a számos, gyógyszerbevétellel kapcsolatos kellemetlen előírás (a gyógyszert éhgyomorra, sima vízzel, álló, vagy egyenesen ülő helyzetben kell bevenni, utána egy ideig nem szabad lefeküdni, enni vagy inni), amely a felső gasztrointesztinális mellékhatások elkerülését és a megfelelő felszívódást biztosítja. Felmérések szerint az oszteoporózis kezelésének első évében a betegek mintegy fele, a harmadik év végére négyötöde nem megfelelően együttműködő. Az alacsony együttműködési készség nagyobb törésszámot eredményezett.
4.2.5. Társadalombiztosítási támogatással adhatók az orális biszfoszfonátok oszteoporotikus csonttörések primer prevenciója céljából azoknak az igazolt oszteoporózissal élő (BMD érték -2,5 SD T-score alatti), de oszteoporotikus csonttörést nem szenvedett posztmenopauzás nő vagy 55 év feletti férfi betegeknek, akiknek a FRAX alapján számított 10 éves törési kockázata magas (általános>20%, illetve csípő>3%). A terápiát megfelelő kalcium- és D-vitaminbevitel (amennyiben nem kontraindikált) biztosításával, továbbá a megfelelő életvezetésre is kiterjedő gondozás mellett kell folytatni.
4.2.6. A különböző hatóanyagok és kiszerelési formák közötti választás alapvetően a kezelőorvos egyéni mérlegelésének és szakmai döntésének tárgya, szem előtt tartva a terápia célját és a várható hatékonyságot, továbbá a terápia tolerálhatóságát; függ az adott beteg paramétereitől és az orvos tapasztalataitól. A készítmények alkalmazása során a maxillo-faciális régióban ritkán (1% alatt) csontnekrózis fordulhat elő, különösen egyes gyógyszerkölcsönhatások (pl. sztatin, szteroidok, egyes hormonkészítmények) miatt. Ezért a gyógyszerkészítmény alkalmazásának megkezdése előtt fogorvosi kivizsgálás és szükség szerinti kezelés elvégzése javasolt.
4.2.7. A költséghatékony kezelés követelményét szem előtt tartva törekedni kell az orális kezelésre, ugyanakkor figyelembe kell venni azokat a körülményeket (például nem megfelelően együttműködő beteg), melyek esetén a parenterális kezelés választása a célravezetőbb.
4.2.8. Az eddigi vizsgálatok szerint a parenterális biszfoszfonátok közül mind a zoledronát (5 mg/év) mind a ibandronát (3 mg/negyedév) hatékony a csontsűrűség javításában és a törési kockázat csökkentésében.
4.2.9. Társadalombiztosítási támogatással adhatók a parenterális biszfoszfonátok oszteoporotikus csonttörések primer prevenciója céljából azoknak az igazolt oszteoporózissal élő (BMD érték -2,5 SD T-score alatti), de oszteoporotikus csonttörést nem szenvedett posztmenopauzás nő vagy 55 év feletti férfi betegeknek, akiknek a FRAX alapján számított 10 éves törési kockázata magas (általános>20%, illetve csípő>3%), de az orális biszfoszfonát kezelés ellenjavallt vagy dokumentált intolerancia vagy a kezelést hátrányosan befolyásoló egyéb tényező miatt nem folytatható. A terápiát megfelelő kalcium- és D-vitaminbevitel (amennyiben nem kontraindikált) biztosításával, továbbá a megfelelő életvezetésre is kiterjedő gondozás mellett kell folytatni.
4.2.10. A biszfoszfonátok alkalmazásánál különösen fontos a megfelelő kalcium és D-vitamin szint fenntartása, a másodlagos PTH-emelkedés kivédésére, illetve a megfelelő hatásosság biztosítására.
4.3. Stroncium ranelát