35/2018. (X. 12.) EMMI rendelet
egyes gyógyszerek társadalombiztosítási támogatásáról szóló miniszteri rendeletek módosításáról1
2018.10.15.
2. A törzskönyvezett gyógyszerek és a különleges táplálkozási igényt kielégítő tápszerek társadalombiztosítási támogatásba való befogadásának szempontjairól és a befogadás vagy a támogatás megváltoztatásáról szóló 32/2004. (IV. 26.) ESZCSM rendelet módosítása
4. § Ez a rendelet 2018. október 15-én lép hatályba.
1. melléklet a 35/2018. (X. 12.) EMMI rendelethez
„TÁMOGATOTT INDIKÁCIÓK:
Felnőttkori súlyos luminaris Crohn-betegség (18 éves kor felett és CDAI > 300) kezelésére – a finanszírozási eljárásrendekről szóló miniszteri rendeletben meghatározott finanszírozási protokoll alapján:
Megfelelő válaszkészség esetén (CDAI minimum 70 pontos csökkenése) a kezelés folytatható mellékhatás, hatásvesztés vagy progresszió megjelenéséig, azonban a kezelőorvosnak mérlegelnie kell a kezelés felfüggesztését legalább 6 hónapja tartó stabil remisszió esetén. Amennyiben a kezelés felfüggesztésre kerül, panaszmentes időszakot követő relapszus esetében a kezelés ismétlése megkísérelhető. Folyamatos kezelés alatt álló betegek esetén a betegség súlyosságát legkésőbb 12 havonta újra szükséges értékelni a kezelés további folytatásának elbírálása érdekében. Mellékhatás vagy hatásvesztés esetén készítményváltás lehetséges.”
„06056 ustekinumab
06005 vedolizumab”
„06056 ustekinumab
06005vedolizumab”
„TÁMOGATOTT INDIKÁCIÓK:
Felnőttkori súlyos (18 éves kor felett, Mayo score ≥ 9) colitis ulcerosa kezelésére, a finanszírozási eljárásrendekről szóló miniszteri rendeletben meghatározott finanszírozási protokoll alapján, amennyiben adekvát immunszupresszió mellett (legalább 2 mg/ttkg vagy a legnagyobb tolerálható dózisú azathioprin) igazolt szisztémás szteroidfüggőség (3 hónapon túl szisztémásan ≥ 10 mg/nap prednisolon ekvivalens dózis) esetén a szteroid adagjának csökkenésekor relapszus (endoszkópos Mayo subscore ≥ 2) igazolható, vagy 3 hónapon át tartó adekvát hagyományos (szteroid indukciós, majd 3 hónapos fenntartó immunszuppresszív) kezelésre nem reagáló súlyos betegségformában (Mayo score > 9 és endoszkópos Mayo subscore ≥ 2), három hónapig, ezt követően kizárólag megfelelő válaszkészség esetén (Mayo score minimum 3 pontos csökkenése) a kezelés kezdetétől számítva legfeljebb egy évig. Akut lefolyású, fulmináns forma, fenyegető colectomia esetén a finanszírozási eljárásrendekről szóló miniszteri rendelet alapján adható.”
„06005 vedolizumab”
6. Az R1. 1/A. számú melléklet 3. pont „OENO KÓD ÉS GYÓGYSZER HATÓANYAGÁNAK NEVE:” megjelölésű része a „06055” megjelölésű sort követően a következő sorokkal egészül ki: „06050 certolizumab-pegol
06067 szekukinumab”
7. Az R1. 1/A. számú melléklet 5. pont „OENO KÓD ÉS GYÓGYSZER HATÓANYAGÁNAK NEVE:” megjelölésű része a „06056” megjelölésű sort követően a következő sorokkal egészül ki: „06067 szekukinumab
06068 ixekizumab”
„06069 baricitinib
06070 tofacitinib”
„06050 certolizumab-pegol”
10. Az R1. 1/A. számú melléklet 7/a. pont „OENO KÓD ÉS GYÓGYSZER HATÓANYAGÁNAK NEVE:” megjelölésű része a „06027” megjelölésű sort követően a következő sorokkal egészül ki: „06003 daratumumab
06004 karfilzomib”
„8/a7.
TÁMOGATOTT INDIKÁCIÓK:
Immunterápia a lokálisan előrehaladott vagy metasztatikus, nem kissejtes tüdőrák (adenocarcinoma vagy laphámsejtes) kezelésére felnőtteknél, az alkalmazási előírásban nevesített biomarkernek megfelelően, a finanszírozási eljárásrendekről szóló miniszteri rendeletben meghatározott finanszírozási eljárásrend alapján.
OENO KÓD ÉS GYÓGYSZER HATÓANYAGÁNAK NEVE:
06002 atezolizumab
06024 nivolumab
06025 pembrolizumab
KOMPETENCIA: INDIKÁLHAT/ALKALMAZHAT
1122 Bács-Kiskun Megyei Kórház, Kecskemét
1301 Koch Róbert Kórház és Rendelőintézet, Edelény
1484 Csongrád Megyei Mellkasi Betegségek Szakkórháza, Deszk
1568 Fejér Megyei Szent György Kórház, Székesfehérvár
1640 Petz Aladár Megyei Oktató Kórház, Győr
1663 Soproni Erzsébet Oktató Kórház és Rehabilitációs Intézet
1876 Szent Borbála Kórház, Tatabánya
1928 Szent Lázár Megyei Kórház, Salgótarján
2010 Pest Megyei Flór Ferenc Kórház, Kistarcsa
2073 Tüdőgyógyintézet, Törökbálint
2137 Somogy Megyei Kaposi Mór Oktató Kórház
2324 Jász-Nagykun-Szolnok Megyei Hetényi Géza Kórház-Rendelőintézet
2425 Tolna Megyei Balassa János Kórház
2601 Veszprém Megyei Tüdőgyógyintézet, Farkasgyepű
2734 Zala Megyei Kórház
2873 Bajcsy-Zsilinszky Kórház és Rendelőintézet
2878 Dél-pesti Centrumkórház-Országos Hematológiai és Infektológiai Intézet
2886 Péterfy Kórház-Rendelőintézet Országos Traumatológiai Intézet
2889 Szent Imre Kórház
2891 Uzsoki utcai Kórház
2894 Debreceni Egyetem Klinikai Központ
2897 Országos Korányi Pulmonológiai Intézet
2899 Mátrai Gyógyintézet
2906 Országos Onkológiai Intézet
2912 Pécsi Tudományegyetem
2915 Semmelweis Egyetem
2917 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
K403 Magyar Honvédség Egészségügyi Központ
N511 Szent Margit Kórház, Budapest
N585 Markhot Ferenc Oktatókórház és Rendelőintézet, Eger
N594 Csolnoky Ferenc Kórház, Veszprém
N595 Markusovszky Egyetemi Oktatókórház, Szombathely
N599 Szabolcs-Szatmár-Bereg Megyei Kórházak és Egyetemi Oktatókórház
R464 Békés Megyei Központi Kórház, Gyula
R730 Borsod-Abaúj-Zemplén Megyei Központi Kórház és Egyetemi Oktatókórház
8/a8.
TÁMOGATOTT INDIKÁCIÓK:
Anaplasticus lymphoma-kináz (ALK)-pozitív, előrehaladott, nem kissejtes tüdőcarcinoma (NSCLC) kezelésére, a finanszírozási eljárásrendekről szóló miniszteri rendeletben meghatározott finanszírozási eljárásrend alapján.
OENO KÓD ÉS GYÓGYSZER HATÓANYAGÁNAK NEVE:
06072 crizotinib
06001 alektinib
KOMPETENCIA: INDIKÁLHAT/ALKALMAZHAT
1122 Bács-Kiskun Megyei Kórház, Kecskemét
1301 Koch Róbert Kórház és Rendelőintézet, Edelény
1484 Csongrád Megyei Mellkasi Betegségek Szakkórháza, Deszk
1568 Fejér Megyei Szent György Kórház, Székesfehérvár
1640 Petz Aladár Megyei Oktató Kórház, Győr
1663 Soproni Erzsébet Oktató Kórház és Rehabilitációs Intézet
1876 Szent Borbála Kórház, Tatabánya
1928 Szent Lázár Megyei Kórház, Salgótarján
2010 Pest Megyei Flór Ferenc Kórház, Kistarcsa
2073 Tüdőgyógyintézet, Törökbálint
2137 Somogy Megyei Kaposi Mór Oktató Kórház
2324 Jász-Nagykun-Szolnok Megyei Hetényi Géza Kórház-Rendelőintézet
2425 Tolna Megyei Balassa János Kórház
2601 Veszprém Megyei Tüdőgyógyintézet, Farkasgyepű
2734 Zala Megyei Kórház
2873 Bajcsy-Zsilinszky Kórház és Rendelőintézet
2878 Dél-pesti Centrumkórház-Országos Hematológiai és Infektológiai Intézet
2886 Péterfy Kórház-Rendelőintézet Országos Traumatológiai Intézet
2889 Szent Imre Kórház
2891 Uzsoki utcai Kórház
2894 Debreceni Egyetem Klinikai Központ
2897 Országos Korányi Pulmonológiai Intézet
2899 Mátrai Gyógyintézet
2906 Országos Onkológiai Intézet
2912 Pécsi Tudományegyetem
2915 Semmelweis Egyetem
2917 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
K403 Magyar Honvédség Egészségügyi Központ
N511 Szent Margit Kórház, Budapest
N585 Markhot Ferenc Oktatókórház és Rendelőintézet, Eger
N594 Csolnoky Ferenc Kórház, Veszprém
N595 Markusovszky Egyetemi Oktatókórház, Szombathely
N599 Szabolcs-Szatmár-Bereg Megyei Kórházak és Egyetemi Oktatókórház
R464 Békés Megyei Központi Kórház, Gyula
R730 Borsod-Abaúj-Zemplén Megyei Központi Kórház és Egyetemi Oktatókórház”
„06009 trastuzumab emtanzine”
„8/c4.
TÁMOGATOTT INDIKÁCIÓK:
Trasztuzumabbal és docetaxellel kombinálva olyan HER2-pozitív metasztatikus vagy lokálisan kiújuló, inoperábilis emlőkarcinómában szenvedő felnőtt betegek kezelésére, akik metasztatikus betegségük kezelésére korábban még nem részesültek HER2-ellenes kezelésben vagy kemoterápiában
OENO KÓD ÉS GYÓGYSZER HATÓANYAGÁNAK NEVE:
06008 pertuzumab
KOMPETENCIA: INDIKÁLHAT/ALKALMAZHAT
1122 Bács-Kiskun Megyei Kórház, Kecskemét
1487 Dr. Bugyi István Kórház, Szentes
1568 Fejér Megyei Szent György Egyetemi Oktató Kórház, Székesfehérvár
1640 Petz Aladár Megyei Oktató Kórház, Győr
1876 Szent Borbála Kórház, Tatabánya
1928 Szent Lázár Megyei Kórház, Salgótarján
2010 Pest Megyei Flór Ferenc Kórház, Kistarcsa
2137 Somogy Megyei Kaposi Mór Oktató Kórház
2324 Jász-Nagykun-Szolnok Megyei Hetényi Géza Kórház-Rendelőintézet
2425 Tolna Megyei Balassa János Kórház
2734 Zala Megyei Kórház
2873 Bajcsy-Zsilinszky Kórház és Rendelőintézet
2878 Dél-pesti Centrumkórház-Országos Hematológiai és Infektológiai Intézet
2886 Péterfy Kórház-Rendelőintézet Országos Traumatológiai Intézet
2889 Szent Imre Kórház
2891 Uzsoki utcai Kórház
2894 Debreceni Egyetem Klinikai Központ
2906 Országos Onkológiai Intézet
2912 Pécsi Tudományegyetem
2915 Semmelweis Egyetem
2917 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
K403 Magyar Honvédség Egészségügyi Központ
N511 Szent Margit Kórház, Budapest
N585 Markhot Ferenc Oktatókórház és Rendelőintézet, Eger
N594 Csolnoky Ferenc Kórház, Veszprém
N595 Markusovszky Egyetemi Oktatókórház, Szombathely
N599 Szabolcs-Szatmár-Bereg Megyei Kórházak és Egyetemi Oktatókórház
R464 Békés Megyei Központi Kórház, Gyula
R730 Borsod-Abaúj-Zemplén Megyei Központi Kórház és Egyetemi Oktatókórház
R787 Debreceni Egyetem Kenézy Gyula Egyetemi Kórház”
14. Az R1. 1/A. számú melléklet 14. pont „OENO KÓD ÉS GYÓGYSZER HATÓANYAGÁNAK NEVE:” megjelölésű része a „06020” megjelölésű sort követően a következő sorokkal egészül ki: „06006 cobimetinib
06007 trametinib”
15. Az R1. 1/A. számú melléklet 15/a. pont „KOMPETENCIA: INDIKÁLHAT/ALKALMAZHAT” megjelölésű része a „2878 Dél-pesti Centrumkórház-Országos Hematológiai és Infektológiai Intézet” megjelölésű sort követően a következő sorral egészül ki: „2879 Jahn Ferenc Dél-pesti Kórház”
„15/c.
TÁMOGATOTT INDIKÁCIÓK:
Olyan metasztatizáló, kasztráció-rezisztens prosztatarákban szenvedő felnőtt férfiak kezelésére javallott, akik sikertelen androgén deprivációs kezelést követően tünetmentesek voltak, vagy enyhe tüneteket mutattak, és akiknél a klinikai állapot alapján a kemoterápiás kezelés még nem indokolt.
OENO KÓD ÉS GYÓGYSZER HATÓANYAGÁNAK NEVE:
06015 abirateron-acetát
KOMPETENCIA: INDIKÁLHAT/ALKALMAZHAT
1122 Bács-Kiskun Megyei Kórház, Kecskemét
1487 Dr. Bugyi István Kórház, Szentes
1568 Fejér Megyei Szent György Egyetemi Oktató Kórház, Székesfehérvár
1640 Petz Aladár Megyei Oktató Kórház, Győr
1876 Szent Borbála Kórház, Tatabánya
1928 Szent Lázár Megyei Kórház, Salgótarján
2010 Pest Megyei Flór Ferenc Kórház, Kistarcsa
2137 Somogy Megyei Kaposi Mór Oktató Kórház
2324 Jász-Nagykun-Szolnok Megyei Hetényi Géza Kórház-Rendelőintézet
2425 Tolna Megyei Balassa János Kórház
2734 Zala Megyei Kórház
2873 Bajcsy-Zsilinszky Kórház és Rendelőintézet
2878 Dél-pesti Centrumkórház-Országos Hematológiai és Infektológiai Intézet
2879 Jahn Ferenc Dél-pesti Kórház
2886 Péterfy Kórház-Rendelőintézet Országos Traumatológiai Intézet
2889 Szent Imre Kórház
2891 Uzsoki utcai Kórház
2894 Debreceni Egyetem Klinikai Központ
2906 Országos Onkológiai Intézet
2912 Pécsi Tudományegyetem Klinikai Központ
2915 Semmelweis Egyetem, Budapest
2917 Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ
K403 Magyar Honvédség Egészségügyi Központ
N511 Szent Margit Kórház, Budapest
N585 Markhot Ferenc Oktatókórház és Rendelőintézet, Eger
N594 Csolnoky Ferenc Kórház, Veszprém
N595 Markusovszky Egyetemi Oktatókórház, Szombathely
N599 Szabolcs-Szatmár-Bereg Megyei Kórházak és Egyetemi Oktatókórház
R464 Békés Megyei Központi Kórház, Gyula
R730 Borsod-Abaúj-Zemplén Megyei Központi Kórház és Egyetemi Oktatókórház
R787 Debreceni Egyetem Kenézy Gyula Egyetemi Kórház”
2. melléklet a 35/2018. (X. 12.) EMMI rendelethez
„TÁMOGATOTT INDIKÁCIÓK:
Perzisztáló allergiás asthma bronchiale kiegészítő kezelése céljából – a finanszírozási eljárásrendekről szóló miniszteri rendeletben meghatározott finanszírozási eljárásrendek (felnőttkori asthma bronchiale és gyermekkori asthma bronchiale) alapján – a következő feltételek teljesülése esetén:
− IgE-szint > 76 NE/ml és az IgE-szint nem haladja meg az alkalmazási előírás szerinti maximális értéket,
− perenniális inhalatív allergénnel szembeni pozitív bőrpróba vagy specifikus IgE kimutatása a szérumban,
− szisztémás szteroid tartós alkalmazása ellenére az asthma nem kontrollált vagy nagy dózisú ICS+LABA alkalmazása ellenére gyakoriak a szisztémás szteroidot igénylő exacerbációk (≥ 4/év),
− FEV1 < ref. 80%-a.
Az anti-IgE-kezelés megkezdését követően évente értékelni kell a kezelés hatását és az anti-IgE-kezelés kizárólag akkor folytatható, ha az utolsó egy év során szisztémás szteroidot igénylő exacerbáció legfeljebb 2 alkalommal fordult elő.
Anti-IgE és anti-IL5 egyidejűleg nem alkalmazható.”
„EÜ100 66.
TÁMOGATOTT INDIKÁCIÓK:
Perzisztáló súlyos eozinofil asthma bronchiale kiegészítő kezelése céljából – a finanszírozási eljárásrendekről szóló miniszteri rendeletben meghatározott finanszírozási eljárásrend (felnőttkori asthma bronchiale) alapján – a következő feltételek teljesülése esetén:
− laboratóriumi vérképvizsgálat által kimutatott perifériás eozinofil sejtszám a terápia megkezdése előtt a készítmény alkalmazási előírásában definiáltnak megfelel, de legalább 300 sejt/µl
− szisztémás szteroid kezelés ellenére az asthma nem kontrollált, vagy az elmúlt 12 hónapban legalább 4 szisztémás szteroid kezelést igénylő asthma exacerbáció alakult ki
− nagydózisú ICS+LABA fenntartó terápia legalább 6 hónapos rendszeres használata ellenére FEV1<80% és nem kontrollált asthma áll fenn
− FEV1< ref. 80%-a
Az anti-IL5-kezelés megkezdését követően évente értékelni kell a kezelés hatását, és az anti-IL5-kezelés kizárólag akkor folytatható, ha az utolsó egy év során szisztémás szteroidot igénylő exacerbáció legfeljebb 2 alkalommal fordult elő.
Anti-IgE és anti-IL5 egyidejűleg nem alkalmazható.
A JAVASLATOT KIÁLLÍTÓ ÉS A GYÓGYSZERT RENDELŐ ORVOS MUNKAHELYÉRE ÉS SZAKKÉPESÍTÉSÉRE VONATKOZÓ ELŐÍRÁSOK:
MUNKAHELY: |
SZAKKÉPESÍTÉS: |
JOGOSULTSÁG: |
Járóbeteg szakrendelés/ Fekvőbeteg gyógyintézet |
Tüdőgyógyászat |
írhat |
ELFOGADHATÓ BNO KÓDOK: (beleértve az összes azonosan kezdődő kódot)
J4590
EÜ100 67.
TÁMOGATOTT INDIKÁCIÓK:
Hormonreceptor-pozitív, humán epidermális növekedési faktor 2 (HER2)-negatív, lokálisan előrehaladott vagy metasztatikus emlőrákos betegek kezelésére, akik korábban az előrehaladott vagy metasztatikus betegségükre kezelést nem kaptak.
A JAVASLATOT KIÁLLÍTÓ ÉS A GYÓGYSZERT RENDELŐ ORVOS MUNKAHELYÉRE ÉS SZAKKÉPESÍTÉSÉRE VONATKOZÓ ELŐÍRÁSOK:
MUNKAHELY: |
SZAKKÉPESÍTÉS: |
JOGOSULTSÁG: |
Járóbeteg szakrendelés/ Fekvőbeteg gyógyintézet |
Klinikai onkológia |
írhat |
ELFOGADHATÓ BNO KÓDOK: (beleértve az összes azonosan kezdődő kódot)
C50
EÜ100 68.
TÁMOGATOTT INDIKÁCIÓK:
Kezdeti endokrin-alapú kezelésként, egy aromatáz-inhibitorral kombinálva, a postmenopausában lévő nőknél a hormonreceptor (HR)-pozitív, humán epidermális növekedési faktor-receptor 2 (HER2)-negatív, lokálisan előrehaladott vagy metasztatizáló emlőrák kezelésére.
A JAVASLATOT KIÁLLÍTÓ ÉS A GYÓGYSZERT RENDELŐ ORVOS MUNKAHELYÉRE ÉS SZAKKÉPESÍTÉSÉRE VONATKOZÓ ELŐÍRÁSOK:
MUNKAHELY: |
SZAKKÉPESÍTÉS: |
JOGOSULTSÁG: |
Járóbeteg szakrendelés/ Fekvőbeteg gyógyintézet |
Klinikai onkológia |
írhat |
ELFOGADHATÓ BNO KÓDOK: (beleértve az összes azonosan kezdődő kódot)
C50”
3. Az R2. 2. számú melléklet EÜ100 34. pontja „Kijelölt intézmények:” megjelölésű része a „Pécs Pécsi Tudományegyetem Klinikai Központ, Neurológiai Klinika” megjelölésű sort követően a következő sorral egészül ki: „Tatabánya Szent Borbála Kórház”
4. Az R2. 2. számú melléklet EÜ100 36/b., pont „Kijelölt intézmények:” megjelölésű része a „Kecskemét Bács-Kiskun Megyei Kórház a Szegedi Tudományegyetem Általános Orvostudományi Kar Oktató Kórháza” megjelölésű sort követően a következő sorral egészül ki: „Keszthely Keszthelyi Kórház és Rendelőintézet”
5. Az R2. 2. számú melléklet EÜ100 38/b., pont „Kijelölt intézmények:” megjelölésű része a „Kecskemét Bács-Kiskun Megyei Kórház a Szegedi Tudományegyetem Általános Orvostudományi Kar Oktató Kórháza” megjelölésű sort követően a következő sorral egészül ki: „Keszthely Keszthelyi Kórház és Rendelőintézet”
6. Az R2. 2. számú melléklet EÜ100 56., pont „Kijelölt intézmények:” megjelölésű része a „Kecskemét Bács-Kiskun Megyei Kórház a Szegedi Tudományegyetem Általános Orvostudományi Kar Oktató Kórháza” megjelölésű sort követően a következő sorral egészül ki: „Keszthely Keszthelyi Kórház és Rendelőintézet”
7. Az R2. 2. számú melléklet EÜ100 36/b. pont „Kijelölt intézmények:” megjelölésű része a „Debrecen Debreceni Egyetem Klinikai Központ, Belgyógyászati Klinika” megjelölésű sort követően a következő sorral egészül ki: „Eger Markhot Ferenc Oktatókórház és Rendelőintézet”
8. Az R2. 2. számú melléklet EÜ100 38/b. pont „Kijelölt intézmények:” megjelölésű része a „Debrecen Debreceni Egyetem Klinikai Központ, Gyermekklinika” megjelölésű sort követően a következő sorral egészül ki: „Eger Markhot Ferenc Oktatókórház és Rendelőintézet”
9. Az R2. 2. számú melléklet EÜ100 56. pont „Kijelölt intézmények:” megjelölésű része a „Debrecen Debreceni Egyetem Klinikai Központ, Belgyógyászati Intézet” megjelölésű sort követően a következő sorral egészül ki: „Eger Markhot Ferenc Oktatókórház és Rendelőintézet”
10. Az R2. 2. számú melléklet EÜ100 8/t., EÜ100 9/b., EÜ100 25., EÜ100 35., EÜ100 36/a., EÜ100 36/b., EÜ100 36/c., EÜ100 37/a., EÜ100 37/b., EÜ100 37/c., EÜ100 38/b., EÜ100 41., EÜ100 42., EÜ100 43., EÜ100 51., EÜ100 52., EÜ100 61., és EÜ100 63. pontjában foglalt táblázatban a „Heim Pál Gyermekkórház” szövegrész helyébe a „Heim Pál Országos Gyermekgyógyászati Intézet” szöveg lép. 11. Az R2. 2. számú melléklet EÜ100 7/a., EÜ100 7/b., EÜ100 8/t., EÜ100 23/a., EÜ100 34., EÜ100 36/a., EÜ100 36/b., EÜ100 36/c., EÜ100 37/a., EÜ100 37/b., EÜ100 37/c., EÜ100 38/b., EÜ100 41., EÜ100 42., EÜ100 43., EÜ100 50., EÜ100 51., EÜ100 56. és EÜ100 63. pontjában foglalt táblázatban az „Egyesített Szent István és Szent László Kórház és Rendelőintézet” szövegrész helyébe a „Dél-pesti Centrumkórház-Országos Hematológiai Intézet” szöveg lép. 12. Az R2. 2. számú melléklet EÜ100 8/t., EÜ100 34. és EÜ100 37/a. pontjában a „Péterfy Sándor Utcai Kórház-Rendelőintézet és Baleseti Központ” szövegrész helyébe a „Péterfy Kórház-Rendelőintézet és Baleseti Központ” szöveg lép.
3. melléklet a 35/2018. (X. 12.) EMMI rendelethez
Az R2. 3. számú melléklet „EÜ 70 százalékos támogatási kategória” megjelölésű része a következő EÜ70 30. ponttal egészül ki: „Eü70 30.
TÁMOGATOTT INDIKÁCIÓK:
Acut coronaria szindrómás betegek (ST elevációs és nem ST elevációs infarktuson átesett betegek, instabil anginás betegek) közül mindazoknál, akik krónikus veseelégtelenségben szenvednek (kreatinin clearance <60 ml/perc).
A JAVASLATOT KIÁLLÍTÓ ÉS A GYÓGYSZERT RENDELŐ ORVOS MUNKAHELYÉRE ÉS SZAKKÉPESÍTÉSÉRE VONATKOZÓ ELŐÍRÁSOK:
MUNKAHELY: |
SZAKKÉPESÍTÉS: |
JOGOSULTSÁG: |
Kijelölt intézmény |
Kardiológia |
javasolhat és írhat |
Háziorvos |
Megkötés nélkül |
javaslatra írhat |
|
SZAKORVOSI JAVASLAT ÉRVÉNYESSÉGI IDEJE: 12 hónap |
ELFOGADHATÓ BNO KÓDOK: (beleértve az összes azonosan kezdődő kódot)
I20.0-I22.9; Z95.5
Kijelölt intézmények:
Város |
Intézmény neve |
Balatonfüred |
Állami Szívkórház |
Budapest |
Bajcsy-Zsilinszky Kórház és Rendelőintézet |
Budapest |
Semmelweis Egyetem |
Budapest |
Gottsegen György Országos Kardiológiai Intézet |
Budapest |
Magyar Honvédség Egészségügyi Központ |
Budapest |
Betegápoló Irgalmas Rend Kórház |
Debrecen |
Debreceni Egyetem Klinikai Központ |
Győr |
Petz Aladár Megyei Oktató Kórház |
Gyula |
Békés Megyei Központi Kórház |
Kaposvár |
Somogy Megyei Kaposi Mór Oktató Kórház |
Kecskemét |
Bács-Kiskun Megyei Kórház a Szegedi Tudományegyetem Általános Orvostudományi Kar Oktató Kórháza |
Miskolc |
Borsod-Abaúj-Zemplén Megyei Központi Kórház és Egyetemi Oktatókórház |
Nyíregyháza |
Szabolcs-Szatmár-Bereg Megyei Kórházak és Egyetemi Oktatókórház |
Pécs |
Pécsi Tudományegyetem Klinikai Központ |
Szeged |
Szegedi Tudományegyetem Szent-Györgyi Albert Klinikai Központ |
Székesfehérvár |
Fejér Megyei Szent György Egyetemi Oktató Kórház |
Szolnok |
Jász-Nagykun- Szolnok Megyei Hetényi Géza Kórház-Rendelőintézet |
Szombathely |
Markusovszky Egyetemi Oktatókórház |
Zalaegerszeg |
Zala Megyei Kórház |
|
„ |
4. melléklet a 35/2018. (X. 12.) EMMI rendelethez
(A veleszületett vérzékenység kezelésére:)
„z) rekombináns technológiával, humán sejtvonalon előállított, elnyújtott felezési-idejű IX. faktor koncentrátum, Fc fúziós fehérje.”
[Krónikus aktív hepatitis C kezelésére (a finanszírozási eljárásrendekről szóló miniszteri rendeletben meghatározott finanszírozási eljárásrend alapján):]
„p) sofosbuvir/velpatasvir.”
5. melléklet a 35/2018. (X. 12.) EMMI rendelethez
A felnőttkori luminális Crohn-betegség diagnosztikájának és kezelésének finanszírozási eljárásrendje
1. Az eljárásrend tárgyát képező betegség, betegcsoport megnevezése
1.1. Felnőttkori Crohn-betegség (luminális)
2. Kórkép leírása
A gyulladásos bélbetegségek (IBD), azaz a colitis ulcerosa és a Crohn-betegség a fejlettebb országokban a rheumatoid arthritis után a második leggyakoribb idült gyulladásos betegségcsoportot képezik. A Crohn-betegség krónikus gyulladásos betegség, amely a gasztrointesztinális traktus bármely területét érintheti, gyakori az intesztinális (pl. szűkület vagy fisztula) és extraintesztinális szövődmények megjelenése. A betegség természetes lefolyása az esetek döntő többségében különböző súlyosságú fellángolások (relapsusok) és nyugalmi időszakok (remissziók) különböző időtartamú váltakozásából áll. A hagyományos terápiás lehetőségek hosszú távú klinikai eredménye a betegek jelentős részében nem megfelelő, a betegség egyes esetekben csak nagy dózisú és elhúzódó szteroid kezelésre reagál, mely a jelen eljárásrendben nem részletezett, akár súlyos mellékhatásokhoz is vezethet. A szteroid kedvező hatásának időtartama azonban viszonylag rövid és a betegek kb. egyharmada már kezdettől fogva rezisztens a kezelésre, vagy később szteroid dependencia alakul ki. Hagyományosan a kezelés célja a remisszió elérése és fenntartása, és ezáltal lehetőleg a szövődmények kialakulásának és a műtéti kezelésnek az elkerülése. A betegség természetes lefolyását a hagyományos gyógyszeres kezeléssel nem tudjuk megváltoztatni a betegek jelentős részében. Crohn-betegségben az évek során 70-80%-ban szűkület, fisztula, tályog alakul ki, reszekciós műtét válik szükségessé. Bár a betegség pontos oka nem tisztázott, a patogenezis megismert tényezői az utóbbi években lehetővé tették új típusú, úgynevezett biológiai gyógyszerek kifejlesztését. Ma a terápiás cél a klinikai és endoszkópos remisszió (nyálkahártya-gyógyulás) elérése, a szteroidmentes remisszió fenntartása, a szövődmények megelőzése, a kórházi kezelések és sebészi kezelés szükségességének mérséklése, az életminőség javítása, a betegség természetes lefolyásának kedvező irányú megváltoztatása.
2.1. A Crohn-betegség aktivitása
A Crohn-betegség súlyosságának megítélésére az eltérő betegségtípusok esetén más-más mérőszámok alkalmasak. Gyulladásos típusú betegségben a CDAI (Crohn’s Disease Activity Index) a legelterjedtebben alkalmazott aktivitási index. A CDAI alapján történő besorolást és az annak megfelelő klinikai állapotot táblázatban részletezzük. A kezelést hatékonynak tekintjük (klinikai válasz), ha a CDAI 70 ponttal csökken, 150 pont alatt remisszióról beszélünk. A csak a felső gastrointestinalis traktust érintő luminalis Crohn-betegség esetén a CDAI nem minden esetben alkalmas a klinikai állapot megítélésére. A műtéti beavatkozás során esetleg kialakított hasfali vendégnyílás (stoma) a székletszám változásán keresztül befolyásolja a CDAI értékét, így ilyenkor az csak becsülhető.
2.2. A szteroid kezelés fő problémái
2.2.1. Szteroid refrakter IBD: ha legalább 0,75 mg/ttkg prednisolon (vagy metil-prednisolon) mellett Crohn-betegség vagy colitis ulcerosa esetén 4 hét kezelés után is aktív a betegség vagy intravénásan alkalmazott 1 mg/ttkg metil-prednisolon esetén egy hét alatt nincs mérhető tüneti javulás és a CRP értéke sem normalizálódik.
2.2.2. Szteroid dependencia: ha 3 hónap alatt nem lehet relapszus nélkül 10 mg prednisolon (vagy metil-prednisolon) alá csökkenteni a gyógyszer adagját, vagy elhagyása után 3 hónapon belül relapszus következik be.
3. Az ellátás igénybevételének finanszírozott szakmai rendje, finanszírozási algoritmusa
4. A felnőttkori Crohn-betegség gyógyszeres kezelési algoritmusa
4.1. Enyhe esetben alapellátásban terminális ileum érintettsége esetén budesonid, esetleg, átmenetileg 5-ASA, illetve a colon érintettsége esetén sulphasalazin kezelés megpróbálható,
4.2. kezdeti szteroid kezelés 3 hónapig,
4.3. korai immunszuppresszív terápia,
4.4. negyedik vonalban: biológiai terápia (biológiai terápia alkalmazására kijelölt intézmények); valamelyik TNF-α gátló alkalmazása: infliximab (az alkalmazott támogatási kategória figyelembevételével); adalimumab; ezek hatástalansága vagy hatásvesztés esetén integrin antagonista vedolizumab vagy interleukin inhibitor ustekinumab.
5. A Crohn-betegség biológiai kezelése
5.1. Indukciós kezelés gyulladásos típusú Crohn-betegségben (luminális): anti-TNF-α indukciós kezelés indikált bármely lokalizációban lévő középsúlyos-súlyos Crohn-betegségben (EL1a, RGB) elsővonalban, ha
5.1.1. az alkalmazott hagyományos (szteroid indukciós, majd 3 hónapos fenntartó immunszupresszív) terápia ellenére a betegség aktivitása nem csökken, vagy
5.1.2. szteroid rezisztencia esetén (4 héten át alkalmazott 0,75 mg/ttkg prednisolon ekvivalens szteroid dózisra nem reagáló), vagy
5.1.3. immunszuppresszáns kezelés (legalább 2 mg/ttkg vagy a legmagasabb tolerált dózisú azatioprin) mellett is szteroid dependencia alakul ki (3 hónapon túl szisztémásan 10 mg/nap dózisnál nagyobb prednisolon ekvivalens dózis), vagy
5.1.4. immunszuppresszáns kezelésre a beteg intoleráns, vagy
5.1.5. a hagyományos gyógykezelés toxicitása miatt nem alkalmazható a teljes indukciós kezelés időtartamáig.
5.1.6. Anti-TNF-α hatástalansága vagy hatásvesztés esetén alkalmazható másodvonalban az integrin antagonista vedolizumab vagy az interleukin inhibitor ustekinumab.
5.2. A Magyarországon jelenleg engedélyezett készítmények közül:
5.2.1. Infliximab (IFX) esetében: 5mg/ttkg intravénás infúzióban, 2 órás infundálási időtartamban a 0., 2. és 6. héten alkalmazva. Az indukciós kezelést követően 6 héten belül nem reagáló betegek további IFX-kezelését nem támasztják alá a rendelkezésre álló adatok.
5.2.2. Adalimumab (ADA) esetében: 80 mg a 0. héten, majd 40 mg a 2. héten. Ha hamarabb szükséges elérni a terápiás hatást, a készítmény alkalmazható a 0. héten 160 mg (a dózis beadható 4 injekcióban egyetlen napon, vagy napi 2 injekcióban két egymást követő napon), a 2. héten 80 mg dózisban annak tudatában, hogy az indukciós kezelés során nagyobb a mellékhatások kockázata.
5.2.3. Vedolizumab (VEDO) 300 mg a 0., 2. és 6. héten alkalmazva. Azoknak a Crohn-betegeknek, akiknél nem mutatkozik terápiás válasz, előnyös lehet egy adag a 10. héten. Crohn-betegek esetében nem szabad folytatni a terápiát, ha a 14. hétre sem figyelhető meg terápiás előny.
5.2.4. Az ustekinumab (UST) terápiát a testtömeg alapján számított egyszeri intravénás adaggal kell elkezdeni az alkalmazási előírásban foglaltak szerint. Az ustekinumab 90 mg első szubkután adása az intravénás dózis után, a 8. héten kell, hogy megtörténjen. Ezt követően 12 hetenkénti adagolás javasolt.
5.3. A biológiai terápia hatékonyságának ellenőrzése Crohn-betegségben
5.3.1. Luminalis Crohn-betegség estében az indukciós kezelést követő (12-14. hét) legalább 70 pontos CDAI esés (reagálás) vagy a CDAI 150 pont alá esése esetében (remisszió) az indukciós kezelést hatékonynak tekintjük.
5.3.2. Szteroid dependens kórforma esetében a biológiai kezelést hatékonynak tekintjük, ha az indukciós kezelés végére a szteroid dózisa legalább a felére csökkenthető. Kombinált kórformákban bármely fenti kritérium teljesítése esetében indokolt a fenntartó kezelés.
6. Fenntartó kezelés felnőttkori Crohn-betegségben (luminális)
6.1. Megfelelő válaszkészség (3 hónap alatt CDAI minimum 70 pontos csökkenése) esetén fenntartó kezelés folytatható önmagában vagy immunszuppresszív terápiával együtt. Extraintesztinális manifesztáció esetében a sikeresség elbírálásában a klinikai jelek javulása a mérvadó (EL3, RG C).
6.2. Infliximab esetében: Hatékony indukciós kezelést követően 8 hetente 5mg/ttkg dózisban.
6.3. Adalimumab esetében: Hatékony indukciós kezelést követően 2 hetente alkalmazott 40 mg dózisban. Reagáló esetekben a kezelés maximális időtartamára, elhagyására vonatkozó ajánlás nem fogalmazható meg (EL3, RG C).
6.4. Vedolizumab esetén a kezelésre reagáló betegeknél a 14. héttől nyolchetente kell folytatni a terápiát.
6.5. Ustekinumab esetén: a hatékony indukciós terápiát követően az ustekinumab 90 mg első szubkután adása az intravénás dózis után, a 8. héten kell, hogy megtörténjen. Ezt követően 12 hetenkénti adagolás javasolt.
7. Különleges megfontolások a biológiai kezeléshez
7.1. Készítményválasztás
Luminalis Crohn-betegség esetén a két hasonló támadáspontú anti-TNF-a szer (infliximab, adalimumab) összehasonlító vizsgálatára nem került sor, és a tanulmányok direkt összevetése nem megbízható, azonban az általános állásfoglalás alapján lényeges különbség a vegyületek hatásosságában nincs. Hasonlóképpen nem rendelkezünk direkt összehasonlító adatokkal az anti-TNF-a és integrin-antagonista készítmények hatékonyságát tekintve. Az anti-TNF-α készítmények és immunszuppresszáns szerek (pl. azathioprin) kombinált alkalmazása előnyös lehet a hatékonyság szempontjából, de a kombinált immunszupresszió esetén gyakoribb mellékhatások (pl. fertőzések) megjelenésével kell számolnunk, így minden esetben a kockázat és az előny gondos mérlegelése mellett lehetséges. A vedolizumab esetében a – leginkább az egyidejű kortikoszteroiddal végzett – kombinációs kezelés hatékonyabbnak bizonyult a Crohn-betegség remissziójának indukciójában, mint az önmagában vagy immunmodulátorokkal egyidejűleg adott vedolizumab.
7.2. Dózismódosítás
7.2.1. Infliximab: Közepesen súlyos-súlyos, aktív Crohn-betegség esetében hatékony indukciós kezelést követően 8 hetente 5mg/ttkg dózisban, a kezdetben reagáló-remisszióba kerülő betegekben hatáscsökkenés-hatásvesztés esetén a dózis 10 mg/ttkg-ra emelhető 8 hetente, vagy a kezelés 4 hetente is alkalmazható 5mg/ttkg dózisban. Ilyenkor fontos azonban a hatásvesztés okának tisztázása, infekció (pl. Clostridium difficile), abscessus, műtétet igénylő szűkület kizárása.
7.2.2. Adalimumab: A javasolt adag 40 mg minden 2. héten, szubkután injekcióban a kezdetben reagáló-remisszióba kerülő betegekben hatáscsökkenés-hatásvesztés esetén a 40 mg-os injekciók adása közötti időintervallum egy hétre csökkenthető. Ilyenkor fontos azonban a hatásvesztés okának tisztázása, infekció (pl. Clostridium difficile) abscessus, műtétet igénylő szűkület kizárása.
7.2.3. Vedolizumab: Közepesen súlyos-súlyos, aktív Crohn-betegség esetében hatékony indukciós kezelést követően a 8 hetente 300 mg-os adagokra kezdetben reagáló-remisszióba kerülő betegekben hatáscsökkenés-hatásvesztés esetén az infúziók közötti időintervallum négy hétre csökkenthető. Ilyenkor fontos azonban a hatásvesztés okának tisztázása, infekció (pl. Clostridium difficile) abscessus, műtétet igénylő szűkület kizárása.
7.2.4. Ustekinumab: a hatékony indukciós terápiát követően az ustekinumab 90 mg első szubkután adása az intravénás dózis után, a 8. héten kell, hogy megtörténjen. Ezt követően 12 hetenkénti adagolás javasolt. Azoknál, akiknél a 12 hetenkénti adagolás mellett megszűnik a válaszreakció, hasznos lehet az adagolási gyakoriság 8 hetenkéntire történő növelése. Ilyenkor fontos azonban a hatásvesztés okának tisztázása, infekció (pl. Clostridium difficile) abscessus, műtétet igénylő szűkület kizárása.
7.3. Készítményváltás: az első vonalban megkezdett anti-TNF-α kezelés során a terápiás válasz elvesztése után, vagy intolerancia esetén másik szerre való váltás megengedett. Jelenleg két anti-TNF-α készítmény áll rendelkezésre Magyarországon ebben az indikációban, közöttük főszabályként váltás csak egy alkalommal javasolt. Az anti-TNF-α kezelés hatástalansága vagy hatásvesztés esetén alkalmazható másodvonalban az integrin antagonista vedolizumab vagy az interleukin inhibitor ustekinumab. A váltás előtt szükséges az aktivitás felmérése, szövődmények (elsősorban infekció, abscessus, műtétet igénylő szűkület) kizárása.
8. Szövődmények monitorozása, ellenőrzése
8.1. Opportunista infekciók
8.2. Malignus betegségek
8.3. Neurológiai eltérések
8.4. Secunder autoimmun betegségek
9. Evidencia szintek és az ajánlások foka (Oxford Centre for Evidence Based Medicine)
9.1. Evidencia szint (EL):
EL: 1a Randomizált kontrollált tanulmány (RCT), Systematic review (SR)
EL: 1b Individuális RCT (szűk konfidencia intervallummal)
EL: 1c Megfelelő
EL: 2a SR (cohort tanulmányok homogének)
EL: 2b Individuális cohort tanulmány (low qualitiy RCT)
EL: 2c „Outcomes” research
EL: 3a SR eset-kontrollált tanulmányok homogenitásával
EL: 3b Individuális eset-kontrollált tanulmány
EL: 4 Eset-sorozatok (rossz minőségű cohort és eset-kontrollált tanulmány)
EL: 5 Szakértői vélemény
9.2. Ajánlás foka (RG):
RG: A 1. evidencia szintű, helytálló tanulmányok
RG: B 2. vagy 3. evidencia szintű, helytálló tanulmányok, vagy extrapolációk az 1. szintű tanulmányokból
RG: C 4. evidencia szintű, helytálló tanulmányok, vagy extrapolációk a 2. vagy 3. szintű tanulmányokból
RG: D 5. szintű evidenciák, zavarosan inkonzisztens vagy inkonkluzív tanulmányok bármely szinten
10. Luminalis Crohn-betegség kiterjedés és aktivitás szerint
10.1. Ileocoecalis Crohn-betegség
(5A) Enyhén aktív (CDAI: 151-220)
Enyhe tünetek, kezelés nem szükséges (EL5, RG D)
Mesalazin - értéke korlátozott (EL1a, RG B)
Budesonid 9 mg/nap (EL2a, RG B)
Antibiotikum nem ajánlott (EL1b, RG A)
(5B) Közepesen aktív (CDAI: 221-450)
Budesonid 9 mg/nap (EL1a, RG A)
Oralis szteroid 1 mg/kg (EL1a, RG A)
Antibiotikum (septicus esetben) (EL5, RG D)
AZA/6-MP vagy MTX (EL1b, RG B)
Biológiai terápia (infliximab, adalimumab, vedolizumab, ustekinumab); (CDAI>300 esetén finanszírozott) (EL1b, RG B): változatlan aktivitás esetén, vagy szteroid-refrakter, dependens, intoleráns esetben
(5C) Súlyosan aktív (CDAI: >450)
Oralis szteroid 1 mg/kg (EL1a, RG A)
Ha a relapszus ritka: oralis szteroid és immunmodulátor
Relapszus esetén biológiai terápia (infliximab, adalimumab, vedolizumab, ustekinumab (EL1a, RG B csak infliximab): immunmodulátorral vagy nélküle
A sebészi megoldás alternatíva lehet (EL5 RG D)
10.2. Vastagbél Crohn-betegség
(5D) Enyhén aktív (CDAI: 151-220)
Sulfasalazin (EL1b, RG A)
Oralis szteroid (EL1a, RG A)
Ha a relapszus ritka: oralis szteroid és immunmodulátor
(5D) Közepes vagy súlyosan aktív (CDAI>220)
Relapszus esetén biológiai terápia (infliximab, adalimumab, vedolizumab, ustekinumab (CDAI>300 esetén finanszírozott): immunmodulátorral vagy nélküle (EL1a, RG B csak infliximab)
A sebészi megoldás alternatíva lehet (EL5, RG D)
10.3. Kiterjedt vékonybél Crohn-betegség
(5E) Enyhén aktív (CDAI: 151-220)
Orális szteroid és AZA/6-MP vagy MTX (EL5, RG D)
(5E) Közepes vagy súlyosan aktív (CDAI>220)
Relapszus esetén biológiai terápia (infliximab, adalimumab, vedolizumab, ustekinumab CDAI>300 esetén finanszírozott): immunmodulátorral, vagy nélküle (EL5, RG D)
Hyperalimentáció (EL4, RG C)
Sebészi megoldás alternatíva lehet
10.4. Várhatóan rossz prognózisú klinikai képpel járó eset
Korai AZA/6-MP/MTX, illetve anti-TNF-α terápia: [fiatalkori kezdet (<40 év) és perianalis CD] (EL5 RG D)
10.5. Nyelőcső, illetve gastroduodenalis Crohn-betegség
(5G) Enyhén aktív
PPI kezelés (EL5, RG D)
Oral szteroid + PPI (EL4, RG C)
Oral szteroid + PPI + AZA vagy MTX (EL4, RG D)
(5G) Közepes/súlyos aktivitásban/refrakter esetben
Anti-TNF-α (szteroid refrakter esetben finanszírozott) (EL4, RG D)
Obstructio esetén dilatáció/sebészi megoldás (EL4, RG C)
11. Aktivitási score-ok gyulladásos bélbetegségben
11.1. CDAI score (Best és mtsi, Gut, 1979).
|
A |
B |
C |
D |
1 |
Jellemző |
Pontszám
(egy hétre) |
Súlyszám |
Részösszeg |
2 |
folyékony vagy rendkívül híg székürítés száma a megelőző 7 napon |
|
x2 |
= |
3 |
A hasi fájdalom/görcsök intenzitása
(a megfelelő 7 nap pontszámai összesen)
0=nem volt
1=enyhe
2=közepes
3=heves |
|
x5 |
= |
4 |
Általános közérzet
(a megfelelő 7 nap pontszámai összesen)
0=általában jó
1=átlag alatti
2=rossz
3=rendkívül rossz
4=szörnyű |
|
x7 |
= |
5 |
Crohn-betegséggel összefüggő tünetek száma:
A=arthritis/ízületi fájdalom
B=iritis/uveitis
C=erythema nodosum/pyoderma/stomatitis
D=fissura ani, fisztula/abscessus perianalis
E=egyéb fistula
F=37,5°C feletti láz a megelőző 7 napban |
|
x20 |
|
6 |
Hasmenés elleni gyógyszeres kezelés
(pl. loperamid, diphenoxylat, opiátok)
0=nem
1=igen |
|
x30 |
|
7 |
Hasi terime
0=nincs
2=bizonytalan
5=egyértelmű |
|
x10 |
|
8 |
Hematokrit
Férfiak (47 - Htk) = pontszám
Nők (42 - Htk) = pontszám |
|
X6 |
|
9 |
Aktuális testsúly (ATS):
Rendes testsúly: |
|
x1 |
|
10 |
(Rendes testsúly - ATS)/ rendes testúly x 100%=pont |
|
|
|
11 |
|
|
|
Összesen: |
12. Gyulladásos típusú Crohn-betegség klinikai súlyosságának meghatározása
12.1. Enyhe-középsúlyos betegség: járóbeteg, láztalan, hasi fájdalom nem jelentős, súlyvesztés nem haladja meg az eredeti testsúly 10%-át; nincsen hasi izomvédekezés, tapintható szövetmassza vagy kiszáradás jelei. (CDAI 150-220)
12.2. Középsúlyos-súlyos beteg: az a beteg, aki az enyhe-középsúlyos betegségre indikált gyógyszerekre nem reagál, lázas, testsúlyvesztése jelentős (>10%), hasi fájdalma van, sipolyképződéssel járó betegsége van, időszakosan hányinger vagy hányás gyötri (mely még nem utal bélelzáródásra), vérszegénysége jelentős. (CDAI: 220-450)
12.3. Súlyos-fulmináns betegség: szájon át alkalmazott szteroid, illetve immunszupprimáló kezelésre nem reagáló beteg, magas lázzal, gyakori hányással, bélelzáródásra utaló egyéb tünetekkel, hasi izomvédekezéssel, jelentős fogyással vagy hasi tályogra utaló klinikai jellel. (CDAI>450)
13. Az indikációk definiálása
13.1. Klasszikus terápia rezisztens Crohn-betegség (3 hónapon keresztül szteroid és optimalizált dózisú immunszuppresszánsra nem reagáló beteg).
13.2. Szteroid függő Crohn-betegség (a szakmai ajánlások szerinti fokozatos szteroid leépítés során egymást követő 2 alkalommal a betegség aktivitása ismét súlyossá válik).
13.3. Akut, terápia rezisztens Crohn-betegség [4 hét teljes dózisú szteroidra nem reagáló beteg, a betegség aktivitása mindvégig súlyos (CDAI>300), immunszuppresszáns terápia megkezdésére nincs idő, hiszen a készítmények 8-12 hét alatt érik el a terápiás hatást].
14. A Crohn-betegség betegnaplójának adatai
14.1. Általános adatok (név, TAJ, diagnózis, dátum a kezdőnap és zárónap feltüntetésével)
14.2. Laza, hasmenéses székletek számának 7 napra történő feltüntetése napi bontásban és összesítve,
14.3. A hasi fájdalom mértékének 7 napra történő feltüntetése napi bontásban és összesítve, (0=nincs, 1=enyhe, 2=tűrhető, 3=erős)
14.4. Általános állapot napi feltüntetése (0=jó, 1=megfelelő, 2=rossz, 3=nagyon rossz, 4=tűrhetetlen)
14.5. A héten észlelt tünetek feltüntetése (0=nem volt/nincs, 1=volt/van): szem tünet; bőr tünet; belső sipoly; láz 37,5 fok felett; ízületi fájdalom; száj-garat fekély; végbél fisszúra, fisztula, tályog; egyéb tünet; megjegyzés
14.6. A hasmenés miatt gyógyszer (bélmozgást csökkentő szerek) bevételére vonatkozó heti adat (0=nem, 1=igen)
14.7. Aktuális testsúly (kg)
15. A finanszírozás szakmai ellenőrzésének alapját képező ellenőrzési sarokpontok
15.1. Adminisztratív ellenőrzési pontok (folyamatba épített ellenőrzés)
15.1.1. Kompetencia szint: intézményi és szakorvosi kompetencia ellenőrzése
15.1.2. Betegadatok (online TAJ ellenőrzés)
15.1.3. Jogszabályban rögzített indikációs terület BNO ellenőrzése
15.2. Szakmai ellenőrzési pontok
Klinikai súlyosság meghatározása egy rögzítést megelőző héten vezetett betegnapló alapján számított Crohn-betegség aktivitási index (CDAI) (kivéve kizárólag felső gastrointestinalis érintettség és sztómával élő beteg esetén, utóbbi esetekben szteroid függőség vagy rezisztencia esetén a szteroid dózis legalább 50%-os csökkenése az ellenőrzés szempontja, de sztómával élő beteg esetén a székletszámot nem tartalmazó CDAI rögzítése is szükséges).
15.2.1. Inaktív betegség: CDAI≤150
15.2.2. Enyhe betegség: 150<CDAI≤220
15.2.3. Közepesen súlyos betegség: 220<CDAI≤300
15.2.4. Súlyos betegség: 300<CDAI≤450
15.2.5. Nagyon súlyos betegség: CDAI>450
15.3. A biológiai terápia kontraindikációinak kizárása és ellenőrzése
15.3.1. TBC kizárása (mellkas RTG)
15.3.2. Egyéb akut és krónikus fertőzések kizárása (pl. hepatitis B és C)
15.3.3. Demyelinizációs betegség (vedolizumab és ustekinumab esetén nem jelent kontraindikációt), SLE kizárása (anamnesztikus adatok alapján)
15.3.4. Terhesség kizárása az indukciós kezelés előtt, majd rendszeres ellenőrzés anamnesztikus adatok alapján, terhesség gyanúja esetén laboratóriumi vizsgálattal
15.3.5. Életvitel módja (fertőzésveszély, tájékoztatás a fertőzés megelőzés módjairól)
15.3.6. Anti-TNF-α készítmények, vedolizumab és ustekinumab alkalmazási előírásában abszolút kontraindikációként szereplő súlyos, aktív fertőzés kizárása, illetve az anti-TNF-α készítmények esetén NYHA III/IV szívelégtelenség kizárása, mely a vedolizumab és az ustekinumab esetén nem jelent kontraindikációt.
15.4. A kezelés monitorizálásának ellenőrzése (kontrollvizsgálat)
15.4.1. 3 havonta: labor (WE, Fvs, CRP, ASAT, ALAT, GGT, Karb, Kreat, Na, K)
15.4.2. 3 havonta: aktivitási index (CDAI meghatározása és dokumentálása)
15.4.3. szteroid refrakter esetben, kizárólag felső gastrointestinalis érintettség esetén a szteroid dózisának legalább 50%-os csökkentése az indukciós kezelés végéig
15.4.4. 6 havonta: mellkas RTG (tüdőgyulladás, TBC kizárása céljából)
15.4.5. 9 hónap óta tartó fenntartó kezelés után, újabb 6 hónapnál hosszabb teljes remisszió (CDAI alacsonyabb, mint 150 pont három egymást követő meghatározás alkalmával) esetén a kezelés felfüggesztése mérlegelésének dokumentálása
15.4.6. 9 hónap óta tartó fenntartó kezelés után, a kezelés tartós folytatása esetén 12 havonta ellenőrző képalkotó vizsgálat (MR vagy endoszkópia, indokolt esetben CT) dokumentálása, valamint a kezelés kezdetén, majd szakmailag indokolt esetben hepatitis B és C szűrés, hepatitis B vakcináció esetén annak dokumentálása
15.4.7. A biológiai terápia megválasztása során a terápiás lépcsők betartásának és a terápia lefolytatásának ellenőrzése
A biológiai terápia során az alkalmazott gyógyszerkészítmények alkalmazási előírásában és az egészségügyi szakellátás társadalombiztosítási finanszírozásának egyes kérdéseiről szóló 9/1993. (IV. 2.) NM rendelet 1/A. számú mellékletének vonatkozó indikációs pontjaiban foglaltakat egyaránt szükséges figyelembe venni. 15.5. Megjegyzés
15.5.1. Immunszuppresszív, immunmoduláns terápia: legalább 2 mg/ttkg, vagy intolerancia esetén a legmagasabb tolerálható dózisú AZA kezelés 3 hónapon át
15.5.2. TNF-α gátlók: adalimumab, infliximab
15.5.3. integrin antagonista: vedolizumab
15.5.4. interleukin inhibitor: ustekinumab
16. A finanszírozási eljárásrend alkalmazásának hatását mérő minőségi indikátorok
16.1. A területre fordított közkiadások alakulása, monitorozása.
16.2. A helyes, finanszírozási algoritmus szerint kezelt betegek aránya.
17. A finanszírozás szempontjából lényeges finanszírozási kódok
17.1. A releváns BNO kódok
|
A |
B |
1 |
Kód |
Elnevezés |
2 |
K5001 |
Terápiarezisztens vékonybél Crohn-betegség |
3 |
K5011 |
Terápiarezisztens vastagbél Crohn-betegség |
4 |
K5081 |
Terápiarezisztens vastag- és vékonybél Crohn-betegség |
5 |
K5012 |
Vastagbél Crohn-betegség fisztulával |
6 |
K5082 |
Vékony- és vastagbél Crohn-betegség fisztulával |
17.2. A releváns ATC kódok
|
A |
B |
C |
D |
1 |
ATC kód |
Hatóanyag |
Kategória |
Megjegyzés |
2 |
A07EC01 |
sulfasalazin |
DMARD |
Betegségmódosító szerek |
3 |
A07EC02 |
mesalasin |
DMARD |
Betegségmódosító szerek |
4 |
L04AX01 |
azathioprin |
DMARD |
Betegségmódosító szerek |
5 |
L04AA33 |
vedolizumab |
BRMD |
Biológiai terápia eszközei |
6 |
L04AB02 |
infliximab |
BRMD |
Biológiai terápia eszközei |
7 |
L04AB04 |
adalimumab |
BRMD |
Biológiai terápia eszközei |
8 |
L04AC05 |
ustekinumab |
BRMD |
Biológiai terápia eszközei |
9 |
H02AB01 |
betamethason |
Szteroid |
Szteroid gyógyszerek |
10 |
H02AB04 |
metilprednizolon |
Szteroid |
Szteroid gyógyszerek |
11 |
H02AB06 |
prednizolon |
Szteroid |
Szteroid gyógyszerek |
12 |
H02AB09 |
hidrokortizon |
Szteroid |
Szteroid gyógyszerek |
13 |
A07EA06 |
budesonid |
Szteroid |
Szteroid gyógyszerek |
18. Rövidítések:
ATC: |
Anatomical Therapeutic Chemical klasszifikáció |
|
BNO: |
Betegségek nemzetközi osztályozása” |
|
”
6. melléklet a 35/2018. (X. 12.) EMMI rendelethez
A felnőttkori fisztulázó Crohn-betegség diagnosztikájának és kezelésének finanszírozási eljárásrendje
1. Az eljárásrend tárgyát képező betegség, betegcsoport megnevezése
Felnőttkori fisztulázó Crohn-betegség
2. Kórkép leírása
A gyulladásos bélbetegségek (IBD), azaz a colitis ulcerosa és a Crohn-betegség a fejlettebb országokban a rheumatoid arthritis után a második leggyakoribb idült gyulladásos betegségcsoportot képezik. A Crohn-betegség krónikus gyulladásos betegség, amely a gasztrointesztinális traktus bármely területét érintheti, gyakori az intesztinális (pl. szűkület vagy fisztula) és extraintesztinális szövődmények megjelenése. A betegség természetes lefolyása az esetek döntő többségében különböző súlyosságú fellángolások (relapsusok) és nyugalmi időszakok (remissziók) különböző időtartamú váltakozásából áll. A hagyományos terápiás lehetőségek hosszú távú klinikai eredménye a betegek jelentős részében nem megfelelő, a betegség egyes esetekben csak nagy dózisú és elhúzódó szteroid kezelésre reagál, mely a jelen eljárásrendben nem részletezett, akár súlyos mellékhatásokhoz is vezethet. A szteroid hatás időtartama azonban viszonylag rövid és a betegek kb. egyharmada már kezdettől fogva rezisztens a kezelésre, vagy később szteroid dependencia alakul ki. Perianalis fistulák kezelésében a szisztémás szteroid kezelés nem indokolt. Hagyományosan a kezelés célja a remisszió elérése és fenntartása, lehetőleg a műtét elkerülése. A betegség természetes lefolyását a hagyományos gyógyszeres kezeléssel bizonyosan nem tudjuk megváltoztatni. Crohn-betegségben az évek során 70-80%-ban szűkület, fisztula, tályog alakul ki, reszekciós műtét válik szükségessé. Bár a betegség pontos oka nem tisztázott, a patogenezis megismert tényezői az utóbbi években lehetővé tették új típusú, úgynevezett biológiai gyógyszerek kifejlesztését. Ma a terápiás cél a fisztulázó Crohn-betegség esetén a fistulák záródása, párhuzamos luminalis érintettség esetén a klinikai és endoszkópos remisszió (nyálkahártya-gyógyulás) elérése, a szteroidmentes remisszió fenntartása, a szövődmények megelőzése, a kórházi kezelések és sebészi kezelés szükségességének mérséklése, az életminőség javítása, a betegség természetes lefolyásának kedvező irányú megváltoztatása.
2.1. A felnőttkori fisztulázó Crohn-betegség aktivitása
A perianalis sipollyal járó betegségformák súlyosságának meghatározására a PDAI (Perianal disease Activity Index) alkalmas (EL5, RG D). PDAI 3 pontos csökkenésekor hatékonynak tartjuk a kezelést (klinikai választ). A remissziót a PDAI alapján a szakirodalom nem definiálja, azonban a sipolyváladékozás teljes megszűnése remissziónak tekinthető (EL2b, RG D). Crohn-betegséghez kapcsolt enterocutan vagy rectovaginalis sipolyok esetén részleges remissziónak tekinthető, ha a kezelés kezdetén aktív fisztulák váladékozása 3 hétnél hosszabb kezelést követően több mint 50%-kal csökken két egymást követő kontroll vizsgálat során. A sipolyváladékozás teljes megszűnése 2 egymást követő kontroll vizsgálat alkalmával remissziónak tekinthető.
3. Az ellátás igénybevételének finanszírozott szakmai rendje, finanszírozási algoritmusa
4. A felnőttkori fisztulázó Crohn-betegség biológiai kezelése
4.1. Indukciós kezelés sipolyozó Crohn-betegségben
Komplex perianális (több sipolynyílású, magas transphinctericus vagy tályoggal szövődött, gyulladt rectum nyálkahártya mellett kialakuló, vagy rectovaginalis helyzetű) vagy enterocutan fisztula esetén második vonalban [antibiotikum és azathioprin kezelés elégtelensége (PDAI>4) vagy intoleranciája esetén] indikált az anti-TNF-α kezelés (EL1a, RGB). Fisztulázó betegségtípusban az első vonalbeli kezelésnek nem része a szisztémás szteroidok alkalmazása. A tályogot drenáló fisztula anti-TNF-α kezelése csak a tályog drenálása (seton behelyezése) után kezdhető meg. Anti-TNF-α terápia hatástalansága vagy hatásvesztés esetén kezdhető meg az integrin antagonista vedolizumab vagy az interleukin inhibitor ustekinumab terápia.
4.2. A Magyarországon jelenleg engedélyezett készítmények közül:
4.2.1. Infliximab esetében: 5 mg/ttkg intravénás infúzióban, 2 órás infundálási időtartamban a 0., 2. és 6. héten alkalmazva. A 10-12. hétig nem reagáló betegek további infliximab kezelését nem támasztják alá a rendelkezésre álló adatok.
4.2.2. Az adalimumab törzskönyvi indikációja nem emeli ki a fisztulával járó Crohn-betegség kezelését, azonban nem is tiltja.
4.2.3. A vedolizumab törzskönyvi indikációja nem emeli ki a fisztulával járó Crohn-betegség kezelését, azonban nem is tiltja.
4.2.4. Az ustekinumab (UST) terápiát a testtömeg alapján számított egyszeri intravénás adaggal kell elkezdeni az alkalmazási előírásban foglaltak szerint. Az ustekimumab 90 mg első szubkután adása az intravénás dózis után, a 8. héten kell, hogy megtörténjen. Ezt követően 12 hetenkénti adagolás javasolt.
4.3. A biológiai indukciós kezelés hatékonyságának ellenőrzése fisztulázó Crohn-betegségben
Fisztulázó kórforma esetében hatékony a kezelés, ha megfelelő fisztula-gyógyulás (PDAI csökkenés>3 pont, vagy ha a drenáló fisztulák számának, illetve a váladékozás mennyiségének legalább 50%-os csökkenése) igazolható.
5. Fenntartó kezelés fisztulázó Crohn-betegségben
5.1. Megfelelő válaszkészség (3 hónap alatt a drenáló fisztulák számának, illetve a váladékozás mennyiségének legalább 50%-os csökkenése vagy a PDAI>3 pontos csökkenése) esetén fenntartó kezelés folytatása javasolt önmagában vagy immunszuppresszív terápiával együtt.
5.2. Infliximab esetében: Hatékony indukciós kezelést követően 8 hetente 5 mg/ttkg dózisban.
5.3. Adalimumab esetében: Hatékony indukciós kezelést követően 2 hetente alkalmazott 40 mg dózisban. Reagáló esetekben a kezelés maximális időtartamára, elhagyására vonatkozó ajánlás nem fogalmazható meg (EL3, RG C).
5.4. Vedolizumab esetében: Hatékony indukciós kezelést követően 8 hetente alkalmazott 300 mg dózisban
5.5. Ustekinumab esetében: Hatékony indukciós terápiát követően az első 90 mg szubkután adag az intravénás dózis után, a 8. héten kell, hogy történjen. Ezt követően 12 hetenkénti adagolás javasolt.
6. Különleges megfontolások a biológiai kezeléshez
6.1. Készítményválasztás
Fisztulázó Crohn-betegség esetén a két anti-TNF-α szer (infliximab, adalimumab) összehasonlító vizsgálatára nem került sor, és a tanulmányok direkt összevetése nem megbízható, azonban az általános állásfoglalás alapján lényeges különbség a vegyületek hatásosságában nincs. Hasonlóképpen nem rendelkezünk direkt összehasonlító adatokkal az anti-TNF-α és integrin-antagonista készítmények hatékonyságát tekintve.
Sipolyozó betegségformában az infliximab EL1b, RGA erősségű, az adalimumab EL1b, RG B erősségű ajánlással alkalmazható. Az ustekinumab alkalmazható fistulázó Crohn-betegségben. A vedolizumab a luminaris aktivitás csökkentésére alkalmazható (EL 1b, RG B).
Kombinált immunszupresszió esetén gyakoribb infekciós mellékhatások megjelenésével kell számolnunk.
6.2. Dózismódosítás
6.2.1. Infliximab: Fisztula-képződéssel járó aktív Crohn-betegség esetén alkalmazott IFX kezelés esetében hatékony indukciós kezelést követően 8 hetente 5 mg/ttkg dózisban, a kezdetben reagáló-remisszióba kerülő betegekben hatáscsökkenés-hatásvesztés esetén a dózis 10 mg/ttkg-ra emelhető 8 hetente vagy 4 hetente 5 mg/ttkg alkalmazható. Ilyenkor fontos azonban a hatásvesztés okának tisztázása abscessus, műtétet igénylő szűkület kizárása.
6.2.2. Adalimumab: A javasolt adag 40 mg minden 2. héten, szubkután injekcióban a kezdetben reagáló-remisszióba kerülő betegekben hatáscsökkenés-vesztés esetén a 40 mg-os injekciók adása közötti időintervallum egy hétre csökkenthető. Ilyenkor fontos azonban a hatásvesztés okának tisztázása, abscessus, műtétet igénylő szűkület kizárása.
6.2.3. Vedolizumab: Közepesen súlyos-súlyos, aktív Crohn-betegség esetében hatékony indukciós kezelést követően a 8 hetente, 300 mg-os adagokra kezdetben reagáló-remisszióba kerülő betegekben hatáscsökkenés-vesztés esetén az infúziók közötti időintervallum 4 hétre csökkenthető. Ilyenkor fontos azonban a hatásvesztés okának tisztázása, infekció (pl. Clostridium difficile) abscessus, műtétet igénylő szűkület kizárása.
6.2.4. Ustekinumab: A hatékony indukciós terápiát követően az ustekinumab 90 mg első szubkután adása az intravénás dózis után, a 8. héten kell, hogy megtörténjen. Ezt követően 12 hetenkénti adagolás javasolt. Azoknál, akiknél a 12 hetenkénti adagolás mellett megszűnik a válaszreakció, hasznos lehet az adagolási gyakoriság 8 hetenkéntire történő növelése. Ilyenkor fontos azonban a hatásvesztés okának tisztázása, infekció (pl. Clostridium difficile) abscessus, műtétet igénylő szűkület kizárása.
6.3. Készítményváltás
A biológiai kezelés során a terápiás válasz elégtelensége vagy a válasz elvesztése után, másik szerre való váltás megengedett. Jelenleg két anti-TNF-α készítmény áll rendelkezésre ebben az indikációban, közöttük főszabályként váltás csak egy alkalommal javasolt. Az anti-TNF-α készítmények hatástalansága vagy hatásvesztés esetén kezdhető meg az integrin antagonista vedolizumab vagy az IL inhibitor ustekinumab terápia. A váltás hatástani csoporton belül vagy között bármely hatóanyag egyszeri alkalmazásával javasolt.
A váltás előtt szükséges az aktivitás felmérése, szövődmények (abscessus, műtétet igénylő szűkület) kizárása.
7. Szövődmények monitorozása, ellenőrzése
7.1. Opportunista infekciók
7.2. Malignus betegségek
7.3. Neurológiai eltérések
7.4. Secunder autoimmun betegségek
8. Evidencia szintek és az ajánlások foka (Oxford Centre for Evidence Based Medicine)
8.1. Evidencia szint (EL):
EL: 1a Randomizált kontrollált tanulmány (RCT), Systematic review (SR)
EL: 1b Individuális RCT (szűk konfidencia intervallummal)
EL: 1c Megfelelő
EL: 2a SR (cohort tanulmányok homogének)
EL: 2b Individuális cohort tanulmány (low qualitiy RCT)
EL: 2c „Outcomes” research
EL: 3a SR eset-kontrollált tanulmányok homogenitásával
EL: 3b Individuális eset-kontrollált tanulmány
EL: 4 Eset-sorozatok (rossz minőségű cohort és eset-kontrollált tanulmány)
EL: 5 Szakértői vélemény
8.2. Ajánlás foka (RG):
RG: A 1. evidencia szintű, helytálló tanulmányok
RG: B 2. vagy 3. evidencia szintű, helytálló tanulmányok, vagy extrapolációk az 1. szintű tanulmányokból
RG: C 4. evidencia szintű, helytálló tanulmányok, vagy extrapolációk a 2. vagy 3. szintű tanulmányokból
RG: D 5. szintű evidenciák, zavarosan inkonzisztens vagy inkonkluzív tanulmányok bármely szinten
9. Fisztulázó Crohn-betegség kezelésének finanszírozott terápiás alkalmazásai
(9F) 1. perianalis tályog = sebészi megoldás (EL5, RG D)
9.1. Fisztula jellege szerint:
9.1.1. Egyszerű fisztula
9.1.2. Összetett fisztula rendszer
9.1.3. Kimenetel-fisztula
9.1.4. Rectovaginalis fisztula
9.2. Egyszerű fisztula
(9G) A fisztula csak panaszok esetén kezelendő
Panaszok esetén seton vagy fistulotomia (EL3, RG D)
Metronidazol és ciprofloxacin kezelés (EL3, RG D)
9.3. Összetett fisztularendszer
(9H) Összetett (komplex fisztula)
Sebészi seton ellátás javasolt (EL4, RG D)
Eltávolítása a kezelés sikerétől függ
(9I) Komplex kezelés
Az aktív luminalis Crohn-betegség kezelése szükséges a sebészi ellátás mellett (EL5, RG D)
(9J) Összetett (komplex fisztula)
Antibiotikum és AZA/6-MP az első terápia a sebészi ellátás mellett (EL4, RG D)
(9K) Második vonal
Infliximab (EL1b, RG A)
Adalimumab (EL1b, RG B)
Mindkét szer a második vonalban (EL1b, RG B)
anti-TNF-α terápia hatástalansága vagy hatásvesztés esetén:
• Vedolizumab a luminaris aktivitás csökkentésére alkalmazható (EL 1b, RG B)
• Ustekinumab
9.4. Kimenetel-fisztula
(9L) Terápiás hatékonyság és mérése
Váladékozás csökkenése (50%) (EL2b, RG D)
Kvantitatív - PDAI (EL5, RG D)
Váladékozás csökkenése (50%) és kismedence MRI vizsgálat (EL2b, RG D)
(9M) Terápia vezetése
AZA/6-MP (EL2b, RG C)
Infliximab (EL1b, RG A)
Adalimumab (EL1b, RG B)
Vedolizumab (EL 1b, RG B)
Ustekinumab
Seton drain (EL4 RG D)
Drainage és gyógyszeres kombináció (EL3 RG C)
Bármelyik fenntartó kezelés legalább 1 évig szükséges (EL1b, RG A)
(9N) Hatástalanság
Hatástalan biológiai terápia esetén tacrolimus vagy (EL1b, RG B) AZA/MTX és antibiotikum (EL5, RG D) visszaadása
Refrakter esetben diverzió (EL4, RG C)
Resectiós műtéti kezelés (pl. proctectomia) az utolsó lépés (EL5, RG D)
(9O) Ellátás speciális esetei
(9P) Rectovaginalis fisztula
Egyszerű anal-introital, tünet nélküli fisztula nem kíván kezelést (EL5, RG D)
Tünettel járó esetben sebészeti kezelés előtt, aktív Crohn-betegség (különösen a rectalis) fennállása esetén kezelendő (EL5, RG D)
Enterocutan fisztula
Részletes kivizsgálást követően, sebésszel történt konzultáció alapján, bélresectio mérlegelése mellett a komplex kezelés részeként, fentiek szerint kezelhető.
Interintesztinális fisztula
Kezelése elsősorban az érintett bélszakasz sebészi resectióján alapul, a gyógyszeres kezelés a sebészeti terápiával összhangban, annak előkészítéseként, kiegészítéseként alkalmazható.
9.5. Fisztula aktivitásának mérése szerint
9.5.1. Váladékozás mértéke alapján: Fisztula hozamának csökkenése 50%-kal
9.5.2. Összetett pontszám alapján: PDAI
10. Aktivitási score perianalis fisztulázó Crohn-betegségben
10.1. Sipolyozó Crohn-betegség súlyosságának meghatározása (PDAI) (Irvine és mtsi, Journal of Clinical Gastroenterology, 1995)
|
A |
B |
1 |
Fisztula hozama |
|
2 |
nem váladékozik |
0 |
3 |
kis nyákos váladékozás |
1 |
4 |
közepes nyákos vagy gennyes váladékozás |
2 |
5 |
jelentős váladékozás |
3 |
6 |
fekulens váladékozás |
4 |
7 |
Fájdalom / aktivitás korlátozottsága |
|
8 |
tevékenységben nem korlátoz |
0 |
9 |
enyhe diszkomfort, korlátozottság nélkül |
1 |
10 |
közepes diszkomfort, bizonyos tevékenységek gátoltak |
2 |
11 |
jelentős diszkomfort, jelentős korlátozottság |
3 |
12 |
súlyos fájdalom és korlátozottság |
4 |
13 |
Szexuális aktivitás korlátozottsága |
|
14 |
nincs korlátozottság |
0 |
15 |
enyhe korlátozottság |
1 |
16 |
közepes korlátozottság |
2 |
17 |
jelentős korlátozottság |
3 |
18 |
szexuális funkciók gátoltak |
4 |
19 |
Perianalis betegség típusa |
|
20 |
nincs perianális megjelenés/skin tag |
0 |
21 |
fissura vagy „mucosal tear” |
1 |
22 |
kevesebb, mint 3 fisztula |
2 |
23 |
több mint 3 fisztula |
3 |
24 |
sphincterkárosodás vagy jelentős perianalis hámhiány |
4 |
25 |
Beszűrtség foka |
|
26 |
nincs beszűrtség |
0 |
27 |
minimális beszűrtség |
1 |
28 |
közepes beszűrtség |
2 |
29 |
jelentős beszűrtség |
3 |
30 |
tályog |
4 |
11. A Crohn-betegség betegnaplójának adatai
11.1. Általános adatok (név, TAJ, diagnózis, dátum a kezdőnap és zárónap feltüntetésével)
11.2. Laza, hasmenéses székletek számának 7 napra történő feltüntetése napi bontásban és összesítve,
11.3. A hasi fájdalom mértékének 7 napra történő feltüntetése napi bontásban és összesítve, (0=nincs, 1=enyhe, 2=tűrhető, 3=erős)
11.4. Általános állapot napi feltüntetése (0=jó, 1=megfelelő, 2=rossz, 3=nagyon rossz, 4=tűrhetetlen)
11.5. A héten észlelt tünetek feltüntetése (0=nem volt/nincs, 1=volt/van): szem tünet; bőr tünet; belső sipoly; láz 37,5 fok felett; ízületi fájdalom; száj-garat fekély; végbél fisszúra, fisztula, tályog; egyéb tünet; megjegyzés
11.6. A hasmenés miatt gyógyszer (bélmozgást csökkentő szerek) bevételére vonatkozó heti adat (0=nem, 1=igen)
11.7. Aktuális testsúly (kg)
12. A finanszírozás szakmai ellenőrzésének alapját képező ellenőrzési sarokpontok
12.1. Adminisztratív ellenőrzési pontok (folyamatba épített ellenőrzés)
12.1.1. Kompetencia szint: intézményi és szakorvosi kompetencia ellenőrzése
12.1.2. Betegadatok (online TAJ ellenőrzés)
12.1.3. Jogszabályban rögzített indikációs terület BNO ellenőrzése
12.2. Szakmai ellenőrzési pontok
12.2.1. A diagnózis kritériumainak rögzítése (BNO: K5012, K5082)
12.2.1.1. A fisztula típusának meghatározása a fizikális status, endoszkópos lelet és a kismedencei képalkotók (MR vagy rectalis UH) vagy EUA (anesztéziában végzett rectalis vizsgálat) alapján
12.2.1.2. Súlyosság meghatározása az alábbi kritériumok alapján (PDAI: perianalis betegség aktivitási index, 0-12)
12.2.1.3. Az indukciós kezelés hatásosságának rögzítése (PDAI csökkenés>3)
12.2.1.4. A 12.2.1.1. pontban felsorolt diagnosztikai módszerekkel igazolt remisszióig
12.2.2. A biológiai terápia kontraindikációinak kizárása és ellenőrzése
12.2.2.1. TBC kizárása (mellkas RTG)
12.2.2.2. Egyéb akut és krónikus fertőzések kizárása (pl. hepatitis B és C szűrés)
12.2.2.3. Demyelinizációs betegség (vedolizumab és ustekinumab esetén nem jelent kontraindikációt) (SLE kizárása (anamnesztikus adatok alapján)
12.2.2.4. Terhesség kizárása az indukciós kezelés előtt, majd rendszeres ellenőrzés az anamnesztikus adatok alapján, terhesség gyanúja esetén laboratóriumi vizsgálattal
12.2.2.5. Életvitel módja (fertőzésveszély, tájékoztatás a fertőzés megelőzés módjairól)
12.2.2.6. Labor: rutin
12.2.2.7. Anti-TNF-α készítmények, vedolizumab és ustekinumab alkalmazási előírásában abszolút kontraindikációként szereplő súlyos, aktív fertőzés kizárása, illetve az anti-TNF-α készítmények esetén NYHA III/IV szívelégtelenség kizárása, mely a vedolizumab és az ustekinumab esetén nem jelent kontraindikációt.
12.2.3. A kezelés monitorizálásának ellenőrzése (kontrollvizsgálat)
12.2.3.1. 3 havonta: labor (WE, Fvs, CRP, ASAT, ALAT, GGT, Karb, Kreat, Na, K)
12.2.3.2. 3 havonta: aktivitási index (PDAI meghatározása és dokumentálása)
12.2.3.3. 6 havonta: mellkas RTG (tüdőgyulladás, TBC kizárása céljából)
12.2.3.4. 9 hónap óta tartó fenntartó kezelés után, a kezelés tartós folytatása esetén ellenőrző képalkotó vizsgálat (MR vagy endoszkópia) mérlegelése, valamint a kezelés kezdetén, majd szakmailag indokolt esetben hepatitis B és C szűrés, hepatitis B vaccinatio esetén annak dokumentálása szükséges.
A biológiai terápia során az alkalmazott gyógyszerkészítmények alkalmazási előírásában és az egészségügyi szakellátás társadalombiztosítási finanszírozásának egyes kérdéseiről szóló 9/1993. (IV. 2.) NM rendelet 1/A. számú mellékletének vonatkozó indikációs pontjaiban foglaltakat egyaránt szükséges figyelembe venni. 12.2.3.5. A biológiai terápia megválasztása során a terápiás lépcsők betartásának és a terápia lefolytatásának ellenőrzése
A biológiai terápia során az alkalmazott gyógyszerkészítmények alkalmazási előírásában és az egészségügyi szakellátás társadalombiztosítási finanszírozásának egyes kérdéseiről szóló 9/1993. (IV. 2.) NM rendelet 1/A. számú mellékletének vonatkozó indikációs pontjaiban foglaltakat egyaránt szükséges figyelembe venni. Megjegyzés
12.2.3.6. Immunszuppresszív, immunmoduláns terápia: legalább 2 mg/ttkg, vagy intolerancia esetén a legmagasabb tolerálható dózisú AZA kezelés 3 hónapon át.
12.2.3.7. TNF-α gátlók: adalimumab, infliximab, integrin antagonista: vedolizumab; IL inhibitor: ustekinumab.
12.2.3.8. Egy éven túli fenntartó kezelés feltétele az MR vagy rectalis UH vagy EUA vizsgálattal igazolt komplett fisztula-záródás.
13. A finanszírozási eljárásrend alkalmazásának hatását mérő minőségi indikátorok
13.1. A területre fordított közkiadások alakulása, monitorozása
13.2. A finanszírozási algoritmus szerint kezelt betegek aránya
14. A finanszírozás szempontjából lényeges finanszírozási kódok
14.1. A releváns BNO kódok
|
A |
B |
1 |
Kód |
Elnevezés |
2 |
K5001 |
Terápiarezisztens vékonybél Crohn-betegség |
3 |
K5011 |
Terápiarezisztens vastagbél Crohn-betegség |
4 |
K5081 |
Terápiarezisztens vastag- és vékonybél Crohn-betegség |
5 |
K5012 |
Vastagbél Crohn-betegség fisztulával |
6 |
K5082 |
Vékony- és vastagbél Crohn-betegség fisztulával |
14.2. A releváns ATC kódok
|
A |
B |
C |
D |
1 |
ATC kód |
Hatóanyag |
Kategória |
Megjegyzés |
2 |
A07EC01 |
sulfasalazin |
DMARD |
Betegségmódosító szerek |
3 |
A07EC02 |
mesalazin |
DMARD |
Betegségmódosító szerek |
4 |
L04AX01 |
azathioprin |
DMARD |
Betegségmódosító szerek |
5 |
L04AA33 |
vedolizumab |
BRMD |
Biológiai terápia eszközei |
6 |
L04AB02 |
infliximab |
BRMD |
Biológiai terápia eszközei |
7 |
L04AB04 |
adalimumab |
BRMD |
Biológiai terápia eszközei |
8 |
L04AC05 |
ustekinumab |
BRMD |
Biológiai terápia eszközei |
9 |
H02AB01 |
betamethason |
Szteroid |
Szteroid gyógyszerek |
10 |
H02AB04 |
metilprednizolon |
Szteroid |
Szteroid gyógyszerek |
11 |
H02AB06 |
prednizolon |
Szteroid |
Szteroid gyógyszerek |
12 |
H02AB09 |
hidrokortizon |
Szteroid |
Szteroid gyógyszerek |
13 |
A07EA06 |
budesonid |
Szteroid |
Szteroid gyógyszerek |
15. Rövidítések:
ATC: |
Anatomical Therapeutic Chemical klasszifikáció |
|
BNO: |
Betegségek nemzetközi osztályozása” |
|
”
7. melléklet a 35/2018. (X. 12.) EMMI rendelethez
A colitis ulcerosa diagnosztikájának és kezelésének finanszírozási eljárásrendje
1. Az eljárásrend tárgyát képező betegség, betegcsoport megnevezése
Colitis ulcerosa
2. Kórkép leírása
A gyulladásos bélbetegségek (IBD), azaz a colitis ulcerosa (CU) és a Crohn-betegség (CD) a fejlettebb országokban a rheumatoid arthritis után a második leggyakoribb idült gyulladásos betegségcsoportot képezik. A colitis ulcerosa a vastagbél nyálkahártyájának fekélyes gyulladása, mely a rectumtól kezdve különböző hosszúságban érintheti a vastagbelet, ritkán a terminális ileumot („back wash ileitis”). A colitis ulcerosa természetes lefolyása az esetek döntő többségében különböző súlyosságú fellángolások (relapsusok) és nyugalmi időszakok (remissziók) különböző időtartamú váltakozásából áll, az esetek egy részében az aktivitás folyamatos. A hagyományos terápiás lehetőségek hosszú távú klinikai eredménye a betegek jelentős részében nem megfelelő, a betegség egyes esetekben csak nagy dózisú és elhúzódó szteroid kezelésre reagál, mely a jelen eljárásrendben nem részletezett, akár súlyos mellékhatásokhoz is vezethet. A szteroid hatás időtartama azonban viszonylag rövid, és a betegek kb. egyharmada már kezdettől fogva rezisztens a kezelésre, vagy később szteroid dependencia alakul ki. Hagyományosan a kezelés célja a remisszió elérése és fenntartása, lehetőleg a műtéti kezelés elkerülése. Colitis ulcerosában gyakoriak a relapszusok, a betegség proximális irányban kiterjedtebbé válhat, az egész vastagbelet érintő esetek 10-20%-ában dysplasia, carcinoma alakul ki. A betegek 10-25%-a proctocolectomiára szorul. Bár a betegség pontos oka nem tisztázott, a patogenezis megismert tényezői az utóbbi években lehetővé tették új típusú, úgynevezett biológiai gyógyszerek kifejlesztését. Ma terápiás cél a klinikai, endoszkópos és szövettani remisszió (nyálkahártya-gyógyulás) elérése, a szteroidmentes remisszió fenntartása, a szövődmények megelőzése, a kórházi kezelések és sebészi kezelés szükségességének mérséklése, az életminőség javítása, a betegség természetes lefolyásának kedvező irányú megváltoztatása.
2.1. Colitis ulcerosa aktivitása
A colitis ulcerosa betegség aktivitását a jelenlegi eljárásrend endoszkópos lelet birtokában a Mayo-score meghatározásával, egyéb esetben a részleges Mayo-score alapján követi.
2.1.1. Mayo score alapján a colitis ulcerosa klinikai súlyosságának meghatározása
inaktív colitis ulcerosa: 0-3 pont között
enyhe colitis ulcerosa: 4-6 pont között
közepes colitis ulcerosa: 7-9 pont között
súlyos colitis ulcerosa: 9 pont felett
2.1.2. Mayo Score (Disease Activity Index) (Schroeder és mtsi., New England Journal of Medicine, 1987). A részleges Mayo-score az endoszkópos subscore-t nem tartalmazza.
|
A |
B |
C |
D |
E |
1 |
|
0 |
1 |
2 |
3 |
2 |
Székletszám |
Normál |
1-2/nap >normál |
3-4/nap >normál |
5/nap >normál |
3 |
Rectalis vérzés |
Nincs |
Vércsíkok |
Egyértelmű |
Többségében vér |
4 |
Nyálkahártya |
Normál |
Enyhén sérülékeny |
Közepesen sérülékeny |
Spontán vérzések |
5 |
Orvos általános megítélése |
Normál |
Enyhe |
Közepes |
Súlyos |
3. Az ellátás igénybevételének finanszírozott szakmai rendje, finanszírozási algoritmusa
4. A Colitis ulcerosa betegnaplójának adatai
4.1. Általános adatok (név, TAJ, diagnózis, dátum a kezdőnap és zárónap feltüntetésével)
4.2. Székletek számának 7 napra történő feltüntetése napi bontásban és átlagolva,
4.3. Véres széklet számának 7 napra történő feltüntetése napi bontásban és átlagolva.
5. Szteroid kezelés fő problémái
5.1. Szteroid refrakter gyulladásos bélbetegség (IBD): akut, súlyos colitis ulcerosa esetében teljes dózisú parenterális szteroid kezelés ellenére 5 nap után is aktív a betegség.
5.2. Szteroid dependencia: ha 3 hónap alatt nem lehet relapszus nélkül 10 mg prednisolon alá csökkenteni a gyógyszer adagját, vagy elhagyása után 3 hónapon belül relapszus következik be.
6. Colitis ulcerosa biológiai kezelése
6.1. Indukciós kezelés súlyos, aktív colitis ulcerosában
6.1.1. Hagyományos kezelésre (5-aminoszalicilát, szteroid, immunszuppresszív szer) nem reagáló, vagy intoleráns, immunszuppresszív szer mellett szteroid dependens, vagy immunszuppresszív szerre intoleráns, közepesen súlyos, krónikusan aktív colitis ulcerosában 5 mg/ttkg infliximab kezelés (a 0., 2. és 6. héten) vagy szubkután adalimumab terápia (0. héten 160 mg, 2. héten 80 mg, majd 2 hetente 40 mg sc. 3 hónapig).
6.1.2. Súlyos, fulmináns, 5 napos intravénás szteroid kezelésre nem reagáló colitis ulcerosában, amennyiben colectomia szükségessége fenyeget a műtéti kezelés előtt egy alkalommal megkísérelhető az 5 mg/ttkg dózisú IFX kezelés. Hatékonyság esetén a teljes indukciós kezelést (5 mg/ttkg IFX parenterálisan a 2. héten és 6. héten) alkalmazni kell. Adalimumab és vedolizumab ebben a betegcsoportban nem alkalmazható.
6.1.3. Vedolizumab indukciós kezelés indikált hagyományos kezelésre (5-aminoszalicilát, szteroid, immunszuppresszív szer) nem reagáló, vagy immunszuppresszív szer mellett szteroid dependens, vagy anti-TNF-α szerre nem reagáló, vagy válaszkészségét elvesztő közepesen súlyos, krónikusan aktív colitis ulcerosában (300 mg a 0., 2. és 6. héten).
6.2. A biológiai indukciós kezelés hatékonyságának ellenőrzése colitis ulcerosában
A komplett indukciós kezelés hatékonyságának felmérésére a részleges Mayo-score javasolt.
6.2.1. Szteroid dependens colitis ulcerosa esetén alkalmazott infliximab, adalimumab vagy vedolizumab kezelés hatékonynak tekinthető, ha változatlanul kielégítő klinikai státusz mellett a szteroid kezelés legalább 3 hónapon át elhagyhatóvá vált.
6.2.2. Szteroid rezisztens (nem fulmináns) colitis ulcerosa esetében a hatékonyság felmérésére a 12. héten alkalmazott, Mayo-subscore (endoszkópos vizsgálat nélkül) legalább 3 pontos csökkenése javasolt.
7. Fenntartó kezelés colitis ulcerosában
7.1. Az infliximabbal történt indukciós kezelés által elért remissziót követően indokolt infliximab fenntartó terápia alkalmazása a 14. héttől 5 mg/ttkg dózisban 8 hetente. A fenntartó kezelés hossza a rendelkezésre álló irodalmi adatok szerint pontosan nem meghatározott. Az egészségbiztosító a rendkívül költséges biológiai terápiához való egyenlő hozzáférés lehetőségére tekintettel maximum egy évig finanszírozza. Inaktív állapotot követő relapszus esetén, hasonlóképpen a megelőző terápiára nem reagáló esetekben ismételt terápiás lehetőségként alkalmazható.
7.2. Az adalimumabbal történt indukciós kezelés által elért remissziót követően indokolt adalimumab fenntartó terápia alkalmazása a 12. héttől szubkután 40 mg dózisban 2 hetente. A fenntartó kezelés hossza nem meghatározott. Az egészségbiztosító a rendkívül költséges biológiai terápiához való egyenlő hozzáférés lehetőségére tekintettel maximum egy évig finanszírozza. Inaktív állapotot követő relapszus esetén, hasonlóképpen a megelőző terápiára nem reagáló esetekben ismételt terápiás lehetőségként alkalmazható.
7.3. A vedolizumabbal történt indukciós kezelés által elért remissziót követően indokolt vedolizumab fenntartó terápia alkalmazása a 14. héttől 300 mg dózisban 8 hetente. A fenntartó kezelés hossza a rendelkezésre álló irodalmi adatok alapján pontosan nem meghatározott. Az egészségbiztosító a rendkívül költséges biológiai terápiához való egyenlő hozzáférés lehetőségére tekintettel maximum egy évig finanszírozza. Inaktív állapotot követő relapszus esetén, hasonlóképpen a megelőző terápiára nem reagáló esetekben, ismételt terápiás lehetőségként alkalmazható.
7.4. Amennyiben a relapszus a kezelés felfüggesztése után 6 hónapon belül lép fel, reindukciós kezelés sem infliximab, sem adalimumab, sem vedolizumab esetén nem indokolt, a fenntartó kezelés folytatása javasolt, de a biológiai terápia újraindítása előtt a relapszus klinikai képét utánzó esetleges egyéb okok kizárása (pl. infectio, szövődmények stb.) szükséges.
8. Különleges megfontolások a biológiai kezeléshez
8.1. A készítményválasztás kérdése:
Az infliximab bizonyítottan hatásos terápia refrakter indeterminált colitis és pouchitis eseteiben is. Az anti-TNF-α készítmények és más immunszuppresszáns szerek (pl. azathioprin vagy szteroid) kombinált alkalmazása a mellékhatások gyakoribb előfordulása miatt (pl. fertőzéses szövődmények) a kockázat és előny mérlegelése után lehetséges.
Az anti-TNF-α szerre nem reagáló, vagy válaszkészségét elvesztő közepesen súlyos, krónikusan aktív colitis ulcerosában kezdhető meg a vedolizumab kezelés.
8.2. Dózismódosítás
Az aktív colitis ulcerosa esetén alkalmazott infliximab kezelés esetében hatékony indukciós kezelést követően 8 hetente 5 mg/ttkg dózisban. Infliximab esetén a dózisemelést a törzskönyvi indikáció nem teszi lehetővé.
Az aktív colitis ulcerosa esetén alkalmazott adalimumab kezelés esetében hatékony indukciós kezelést követően 2 hetente 40 mg dózisban. Adalimumab esetén a dózisemelést a törzskönyvi indikáció nem teszi lehetővé, de azon betegeknél, akiknél csökken a terápiás hatás, lehetőséget ad a 40 mg-os dózis hetenként történő alkalmazására. Ilyenkor amennyiben lehetséges, a hatásvesztés okának tisztázása javasolt.
Vedolizumab: Közepesen súlyos- súlyos, aktív colitis ulcerosa esetében hatékony indukciós kezelést követően a 8 hetente, 300 mg-os adagokra kezdetben reagáló-remisszióba kerülő betegekben hatáscsökkenés-vesztés esetén az infúziók közötti időintervallum négy hétre csökkenthető. Ilyenkor – amennyiben lehetséges – a hatásvesztés okának tisztázása javasolt.
8.3. Készítményváltás
A biológiai kezelés során a terápiás válasz elégtelensége vagy a válasz elvesztése után, másik szerre való váltás megengedett. Jelenleg két anti-TNF-α és egy integrin-antagonista készítmény áll rendelkezésre Magyarországon ebben az indikációban, közöttük főszabályként váltás hatástani csoporton belül vagy azok között, bármely hatóanyag egyszeri alkalmazásával javasolt. A váltás előtt szükséges az aktivitás felmérése, szövődmények (pl. fertőzések) kizárása.
Az anti-TNF-α szerre nem reagáló, vagy válaszkészségét elvesztő közepesen súlyos, krónikusan aktív colitis ulcerosában kezdhető meg a vedolizumab kezelés.
9. Emelt, indikációhoz kötött társadalombiztosítási támogatással adható készítmények
Salazopyrin intolerancia, illetve jelentős szisztémás szteroid mellékhatás esetén az életkorra vonatkozó indikációs megkötések és az adott készítmény alkalmazási előírásában szereplő javallatok figyelembevételével: budesonid, mesalazin hatóanyagú készímények (Eü90, 11/b).
10. Szövődmények monitorozása, ellenőrzése
10.1. Opportunista infekciók
10.2. Malignus betegségek
10.3. Neurológiai eltérések
10.4. Indukált autoimmun kórképek
11. A felnőttkori colitis ulcerosa finanszírozásának ellenőrzési kritériumai
11.1. Adminisztratív ellenőrzési pontok (folyamatba épített ellenőrzés)
11.1.1. Kompetencia szint: intézményi és szakorvosi kompetencia ellenőrzése
11.1.2. Betegadatok (online TAJ ellenőrzés)
11.1.3. Jogszabályban rögzített indikációs terület BNO ellenőrzése
11.2. Szakmai ellenőrzési pontok
A diagnózis kritériumainak rögzítése (BNO: K5180, K5190) klinikai tünetek és endoszkópos lelet alapján. A betegség klinikai tüneteinek és aktivitásának meghatározása (a vizitet megelőző egy héten át vezetett betegnapló alapján) és dokumentálásának ellenőrzése (Mayo score).
11.2.1. Klinikai tünetek Mayo kritériumok alapján: Mayo score maximum 12 pont
11.2.2. Enyhe colitis ulcerosa (Mayo score ≤6)
11.2.3. Közepesen súlyos colitis ulcerosa (6< Mayo score ≤9)
11.2.4. Súlyos colitis ulcerosa (Mayo score >9)
11.3. A biológiai terápia kontraindikációinak kizárása és ellenőrzése
11.3.1. TBC kizárása (mellkas RTG)
11.3.2. Egyéb akut és krónikus fertőzések kizárása (pl. hepatitis B és C szűrés)
11.3.3. Demyelinizációs betegség (vedolizumab esetén nem jelent kontraindikációt), SLE kizárása (anamnesztikus adatok alapján)
11.3.4. Terhesség kizárása az indukciós kezelés előtt, majd rendszeres ellenőrzés az anamnesztikus adatok alapján, terhesség gyanúja esetén laboratóriumi vizsgálattal
11.3.5. Életvitel módja (fertőzésveszély, tájékoztatás a fertőzés megelőzés módjairól)
11.3.6. Labor: rutin
11.3.7. Anti-TNF-α készítmények és vedolizumab alkalmazási előírásában abszolút kontraindikációként szereplő súlyos, aktív fertőzés kizárása, illetve az anti-TNF-α készítmények esetén NYHA III/IV szívelégtelenség kizárása, mely a vedolizumab esetén nem jelent kontraindikációt.
11.4. A kezelés monitorizálásának ellenőrzése (kontrollvizsgálat)
11.4.1. 3 havonta: labor (WE, Fvs, CRP, ASAT, ALAT, GGT, Karb, Kreat, Na, K)
11.4.2. 3 havonta: aktivitási index (endoscopia nélküli Mayo subscore meghatározása és dokumentálása)
11.4.3. 6 havonta: mellkas RTG (tüdőgyulladás, TBC kizárása céljából)
11.4.4. A kezelés kezdetén, majd szakmailag indokolt esetben hepatitis B és C szűrés, hepatitis B vaccinatio esetén annak dokumentálása szükséges.
A biológiai terápia során az alkalmazott gyógyszerkészítmények alkalmazási előírásában és az egészségügyi szakellátás társadalombiztosítási finanszírozásának egyes kérdéseiről szóló 9/1993. (IV. 2.) NM rendelet 1/A. számú mellékletének vonatkozó indikációs pontjaiban foglaltakat egyaránt szükséges figyelembe venni. 11.5. Megjegyzés
11.5.1. Súlyos: Mayo score 9
11.5.2. Immunszuppresszív, immunmoduláns terápia: legalább 2 mg/ttkg, vagy intolerancia esetén a legmagasabb tolerálható dózisú AZA kezelés 3 hónapon át
11.5.3. Fenyegető colectomia esetén sebészeti konzílium szükséges akut súlyos, iv. szteroid-refrakter esetben
11.5.4. Legalább 2 mg/ttkg dózisú, vagy a legnagyobb tolerálható dózisú AZA mellett szisztémás szteroid igény 3 hónapon át (10 mg prednisolon ekvivalens szteroid dózis alatt Mayo≥9 és Mayo≥2 endoszkópos subscore)
11.5.5. Mayo score csökkenése minimum 3 ponttal
A biológiai terápia során az alkalmazott gyógyszerkészítmények alkalmazási előírásában és az egészségügyi szakellátás társadalombiztosítási finanszírozásának egyes kérdéseiről szóló 9/1993. (IV. 2.) NM rendelet 1/A. számú mellékletének vonatkozó indikációs pontjaiban foglaltakat egyaránt szükséges figyelembe venni. 12. A finanszírozási eljárásrend alkalmazásának hatását mérő minőségi indikátorok
12.1. A területre fordított közkiadások alakulása, monitorozása.
12.2. A finanszírozási algoritmus szerint kezelt betegek aránya.
13. A finanszírozás szempontjából lényeges finanszírozási kódok
13.1. A releváns BNO kódok
|
A |
B |
1 |
Kód |
Elnevezés |
2 |
K5180 |
Colitis ulcerosa egyéb |
3 |
K5190 |
Colitis ulcerosa k.m.n. |
13.2. A releváns ATC kódok
|
A |
B |
C |
D |
1 |
ATC kód |
Hatóanyag |
Kategória |
Megjegyzés |
2 |
A07EC01 |
szulfasalazin |
DMARD |
Betegségmódosító szerek |
3 |
A07EC02 |
mesalazin |
DMARD |
Betegségmódosító szerek |
4 |
L04AD01 |
ciklosporin |
DMARD |
Betegségmódosító szerek |
5 |
L04AX01 |
azathioprin |
DMARD |
Betegségmódosító szerek |
6 |
L04AB02 |
infliximab |
BRMD |
Biológiai terápia eszközei |
7 |
L04AA33 |
vedolizumab |
BRMD |
Biológiai terápia eszközei |
8 |
L04AB04 |
adalimumab |
BRMD |
Biológiai terápia eszközei |
9 |
H02AB01 |
betamethason |
Szteroid |
Szteroid gyógyszerek |
10 |
H02AB04 |
metilprednizolon |
Szteroid |
Szteroid gyógyszerek |
11 |
H02AB06 |
prednizolon |
Szteroid |
Szteroid gyógyszerek |
12 |
H02AB09 |
hidrokortizon |
Szteroid |
Szteroid gyógyszerek |
13 |
A07EA06 |
budesonid |
Szteroid |
Szteroid gyógyszerek |
14. Rövidítések:
ATC: |
Anatomical Therapeutic Chemical klasszifikáció |
|
BNO: |
Betegségek nemzetközi osztályozása” |
|
”
8. melléklet a 35/2018. (X. 12.) EMMI rendelethez
„6.3.4. Interleukin-inhibitor: usztekinumab, ixekizumab szekukinumab”
(1 |
ATC-kód |
Hatóanyag |
Kategória |
Megjegyzés) |
„
9 |
L04AC10 |
szekukinumab |
BRMD |
Biológiai terápia eszközei |
10 |
L04AC13 |
ixekizumab |
BRMD |
Biológiai terápia eszközei |
„
9. melléklet a 35/2018. (X. 12.) EMMI rendelethez
„3. Az ellátás igénybevételének finanszírozott szakmai rendje, finanszírozási algoritmusa
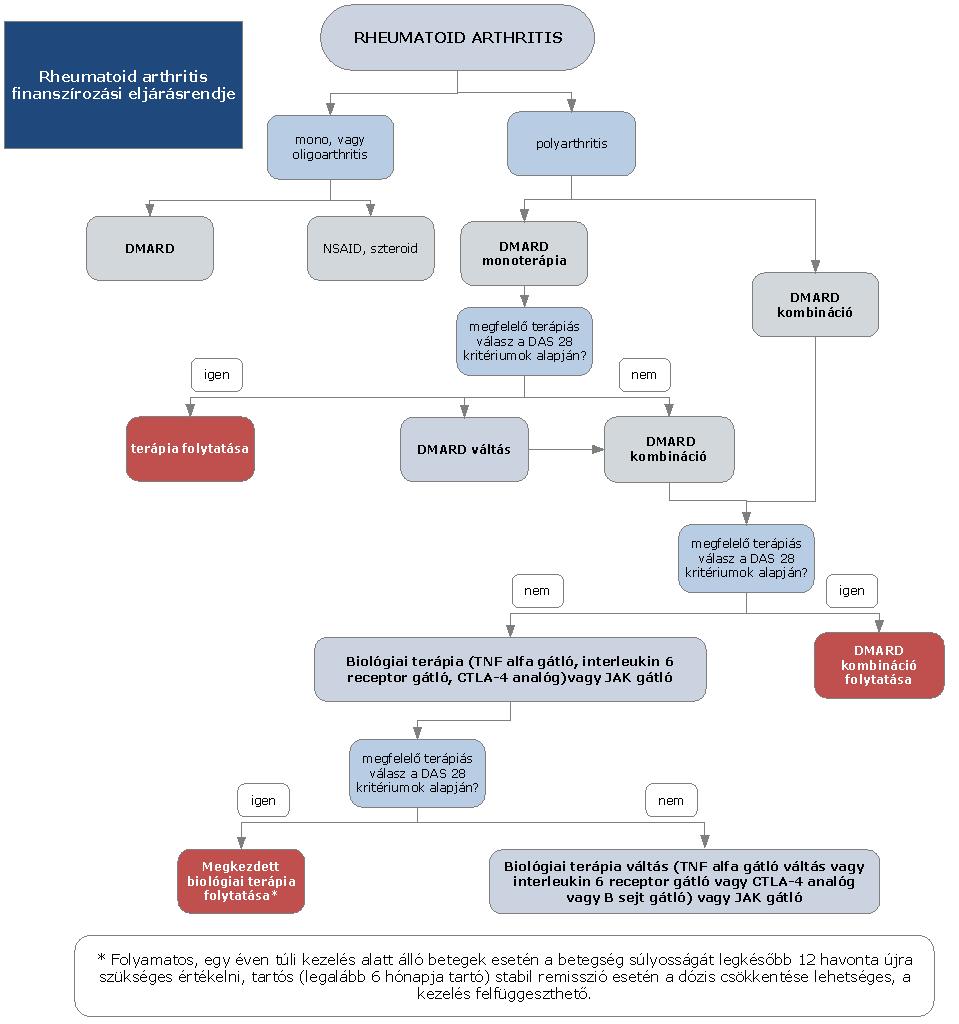 ”
”„4.5. Célzott szintetikus DMARD
JAK gátlók: baricitinib, tofacitinib”
„4.6. Autológ őssejttranszplantáció (opcionálisan, nem rutinszerű)”
„5.3. Célzott szintetikus DMARD terápia (JAK gátlók)
5.3.1. Közepesen súlyos vagy súlyos aktív RA esetén azon betegeknél, akik esetében a 3 hónapig alkalmazott kombinációs DMARD (beleértve a metothrexátot, vagy hatástalanság és intolerancia esetén a leflunomid alkalmazást is) kezelés ellenére a DAS28 szerinti betegségaktivitás magas, illetve egyéb rossz prognosztikai faktorok (seropozitivitás, vagy struktúrális izületi károsodás, vagy magas betegség aktivitás, vagy kettő vagy több konvencionális DMARD kezelés hatástalansága vagy intoleranciája) állnak fenn.
5.3.2. A JAK gátlók alkalmazása a biológiai terápiát követően kezdhető meg.”
„7.2.6.7. Célzott szintetikus DMARD terápia (JAK gátlók): baricitinib, tofacitinib”
„9.2. Táblázat: Releváns ATC kódok
|
A |
B |
C |
D |
|
ATC kód |
Hatóanyag |
Kategória |
Megjegyzés |
1 |
A07EC01 |
sulfasalazin |
DMARD |
Betegségmódosító szerek |
2 |
L01BA01 |
metotrexát |
DMARD |
Betegségmódosító szerek |
3 |
L04AA13 |
LEF |
DMARD |
Betegségmódosító szerek |
4 |
L04AD01 |
ciklosporin |
DMARD |
Betegségmódosító szerek |
5 |
L04AX01 |
azathioprin |
DMARD |
Betegségmódosító szerek |
6 |
P01BA01 |
chloroquin |
DMARD |
Betegségmódosító szerek |
7 |
L04AB01 |
etanercept |
TNF alfa gátló |
Biológiai terápia eszközei |
8 |
L04AA24 |
abatacept |
CTLA-4 analóg |
Biológiai terápia eszközei |
9 |
L04AA29 |
tofacitinib |
JAK gátló |
Betegségmódosító szerek |
10 |
L04AA37 |
baricitinib |
JAK gátló |
Betegségmódosító szerek |
11 |
L04AB02 |
infliximab |
TNF alfa gátló |
Biológiai terápia eszközei |
12 |
L04AB04 |
adalimumab |
TNF alfa gátló |
Biológiai terápia eszközei |
13 |
L04AB06 |
golimumab |
TNF alfa gátló |
Biológiai terápia eszközei |
14 |
L04AB05 |
certolizumab-pegol |
TNF alfa gátló |
Biológiai terápia eszközei |
15 |
L04AC07 |
tocilizumab |
IL-6 R gátló |
Biológiai terápia eszközei |
16 |
L01XC02 |
rituximab |
B sejt gátló |
Biológiai terápia eszközei |
17 |
M01A |
NSAID |
NSAID |
Nem szteroid gyulladáscsökkentő |
18 |
H02AB04 |
metilprednizolon |
Szteroid |
Szteroid gyógyszerek |
19 |
H02AB06 |
prednizolon |
Szteroid |
Szteroid gyógyszerek |
20 |
H02AB08 |
triamcinolon |
Szteroid |
Szteroid gyógyszerek |
„
„JAK Janus-kináz”
8. Az R3. 11. melléklet 6. pontjában a „TNF-α gátló kezelés és az interleukin-6 receptor gátló” szövegrész helyébe a „TNF-α gátló kezelés, interleukin-6 receptor gátló-, valamint JAK gátló” szöveg lép.
10. melléklet a 35/2018. (X. 12.) EMMI rendelethez
„3. Az ellátás igénybevételének finanszírozott szakmai rendje, finanszírozási algoritmusa
 ”
”„4.4.2. Valamelyik TNF-α gátló: infliximab (az alkalmazott támogatási kategória figyelembevételével), etanercept, adalimumab, golimumab, certolizumab-pegol.”
„4.4.3. Interleukin 17 inhibitor: szekukinumab”
„4.7. Interleukin inhibitor kezelés szempontjai
4.7.1. A javasolt adag kezdő adagolásként a 0., 1., 2., 3. és 4. héten 150 mg szubkután injekcióban, melyet a 4. héttől kezdve havonkénti fenntartó adagolás követ. A klinikai válaszreakció rendszerint 16 hetes kezelés alatt kialakul. A kezelés abbahagyása mérlegelendő azoknál a betegeknél, akik 16 hetes kezelés alatt nem mutattak válaszreakciót.
4.7.2. A terápia megkezdését különösen mérlegelni szükséges krónikus, recurrens fertőzésekben szenvedő betegeknél, Crohn-betegségben, esedékes védőoltások és egyéb terápiák esetén (pl. immunszupresszánsok, UV fototerápia) az alkalmazási előírásban foglaltak szerint.
4.8. Folyamatos, egy éven túli kezelés alatt álló betegek esetén a betegség súlyosságát legkésőbb 12 havonta újra szükséges értékelni, tartós (legalább 6 hónapja tartó) stabil remisszió esetén az adagolás intervallumának fokozatos növelése lehetséges, a kezelés felfüggeszthető.
4.9. Csak szakavatott és a terápia alkalmazásában jártas, kijelölt intézmények szakorvosainak kompetenciája az anti-TNF-α és az interleukin inhibitor terápia indikálása és alkalmazása.”
„10.2. Releváns ATC kódok
|
A |
B |
C |
D |
|
ATC kód |
Hatóanyag |
Kategória |
Megjegyzés |
1 |
A07EC01 |
sulfasalazin |
DMARD |
Betegségmódosító szerek |
2 |
L04AB02 |
infliximab |
TNF-alfa gátló |
Biológiai terápia eszközei |
3 |
L04AB01 |
etanercept |
TNF-alfa gátló |
Biológiai terápia eszközei |
4 |
L04AB04 |
adalimumab |
TNF-alfa gátló |
Biológiai terápia eszközei |
5 |
L04AB05 |
certolizumab-pegol |
TNF-alfa gátló |
Biológiai terápia eszközei |
6 |
L04AB06 |
golimumab |
TNF-alfa gátló |
Biológiai terápia eszközei |
7 |
L04AC10 |
szekukinumab |
IL 17 inhibitor |
Biológiai terápia eszközei |
8 |
M01A |
NSAID |
NSAID |
Nem szteroid gyulladáscsökkentő |
9 |
H02AB04 |
metilprednizolon |
Szteroid |
Szteroid gyógyszerek |
10 |
H02AB06 |
prednizolon |
Szteroid |
Szteroid gyógyszerek |
11 |
H02AB08 |
triamcinolon |
Szteroid |
Szteroid gyógyszerek |
„
(1 |
Rövidítés |
Megnevezés) |
„11. |
IL |
Interleukin” |
11. melléklet a 35/2018. (X. 12.) EMMI rendelethez
A hepatitis C vírus okozta krónikus májgyulladás diagnosztikájának és kezelésének finanszírozási eljárásrendje
1. Az eljárásrend tárgyát képező betegség, betegcsoport megnevezése
Hepatitis C vírus által okozott idült májgyulladás B1820
Fogalmak:
1.1. Cirrhosis: az irányelv szempontjából ide értendők mindazok a betegek, akiknél szövettani vizsgálattal előrehaladott (bridging) fibrosis vagy definitív cirrhosis alakult ki (tehát Metavir és Knodell F3-F4 vagy Ishak F4-F5-F6), FibroScan vizsgálattal a máj stiffness 12 kPa feletti vagy Shear Wave Elastography vizsgálattal a LS >10,4 kPa vagy az Extended Liver Function (ELF) biokémiai teszt értéke >11,3 vagy más validált vizsgálómódszer cirrhosisra utal.
1.2. Detekciós limit (DL): a HCV-RNS kimutathatóságának határértéke. A HCV kezelése során elvárás a 15 NE/ml-nél nem magasabb detekciós küszöbértékű real-time polimeráz láncreakció (rt-PCR) módszer alkalmazása.
1.3. Direkt ható antiviralis szerek (DAA): a hepatitis C vírus szaporodásának egyes fázisaira ható vegyületek. Csoportjai: proteázgátlók (PI, NS3-NS4A), NS5A replikációs komplex gátlók vagy NS5B polimerázgátlók
1.4. Hepatitis Regiszter (HepReg): a szakmai szervezetek által létrehozott, a Nemzeti Egészségbiztosítási Alapkezelő (a továbbiakban: NEAK) gyógyszer-allokációját is támogató, a Hepatitis C vírussal fertőzött betegek és kezelésük nyilvántartására, valamint követésére létrehozott internet alapú adatbázis
1.5. Hepatitis Terápiás Bizottság: a krónikus vírushepatitises betegek ellátásában érintett szakmai szervezetek által létrehozott, a szervezetek által delegált tagokból álló testület
1.6. IFN-ellenjavallat: az interferon készítmények alkalmazási előírásaiban felsorolt ellenjavallatok.
1.7. IFN-intolerancia: korábbi IFN-alapú kezelés során, azzal összefüggésben kialakult, a kezelés felfüggesztését eredményező, IFN ismételt adása esetén potenciálisan újra kialakuló súlyos mellékhatás.
1.8. Korábban sikertelenül kezelt beteg: a finanszírozási eljárásrend szempontjából mindazok, akik korábban legalább 12 hetes PR kettős vagy PRP hármas kezelés során nem váltak PCR negatívvá vagy vírusáttörés, illetve relapszus volt tapasztalható, vagy súlyos mellékhatás miatt a kezelés felfüggesztése vált szükségessé.
1.9. Krónikus hepatitis C: a hepatitis C vírus fertőzés talaján kialakult idült májgyulladás
1.10. Naiv-nak minősülő beteg: a finanszírozási eljárásrend szempontjából naiv-nak minősülnek mindazok, akik soha nem részesültek kezelésben, akik csak nem-pegilált IFN±RBV kezelésben részesültek, és akiknél a korábbi IFN±RBV kezelés nem STOP-szabály vagy súlyos mellékhatás miatt állt le.
1.11. Negatív PCR: a nem detektálható HCV-RNS jelent PCR negativitást.
1.12. Nem detektálható HCV: a HCV-RNS 15 IU/ml-nél nem nagyobb detekciós határú Real-Time PCR módszerrel nem mutatható ki.
1.13. Null-reagáló beteg: PR kettős kezelés során a HCV-RNS-szint csökkenése 4 hét elteltével nem éri el az 1 log10 mértéket (nem csökken legalább 1/10-ed részére) vagy 12 hét elteltével nem érte el a 2 log10 nagyságrendet (nem csökken legalább 1/100-ad részére).
1.14. Prioritási Index: a májfibrosis mértékén alapuló, a májkárosodás súlyosságát és szövődményeit, a betegség aktivitását, az átvitel veszélyét és további meghatározott speciális szempontokat is figyelembe vevő, a HCV-fertőzött betegek kezelésbe vonásának szakmailag indokolt sorrendjét meghatározó numerikus érték.
1.15. Proteázgátló kezeléssel sikertelenül kezelt betegek: mindazok, akik PegIFN+RBV+PI kezeléssel nem gyógyultak meg (nem reagáltak, STOP-szabály alá estek vagy vírusáttörés, illetve relapsus vagy súlyos mellékhatás jelentkezett).
1.16. PR kettős kezelés: Pegilált interferon (PegIFN) + ribavirin (RBV) kezelés.
1.17. Rapid vírusválasz (RVR: rapid virologic response): a kezelés megkezdését követően 4 héttel a HCV-RNS nem mutatható ki.
1.18. Relabáló beteg: a kezelés befejezésekor a HCV-RNS nem detektálható, de a kezelés befejezése után ismét kimutatható.
1.19. STOP-szabály: nem megfelelő vírusválasz miatti korai kezelés-befejezés.
1.20. Tartós vírusválasz (SVR): a kezelés befejezését követően 24 héttel a HCV-RNS nem mutatható ki.
1.21. Vírusáttörést mutató beteg: a kezelés alatt nem detektálható HCV-RNS később a kezelés során ismét kimutathatóvá vált.
1.22. Vírusrezisztencia (VR), rezisztencia-asszociált vírusvariáns (RAV), rezisztencia-asszociált szubsztitúció (RAS): a DAA-ra nem érzékeny HCV törzsek >10%-os gyakoriságú kimutathatósága a kezelés megkezdése előtt (kiinduló rezisztencia), vagy ilyen arányú felszaporodása DAA kezelés alatt (terápia-asszociált rezisztencia).
2. Kórkép leírása
A hepatitis C vírus (HCV) okozta májgyulladás a transzfúziós hepatitisek leggyakoribb oka volt. A világban kb. 170 millióra becsülik a hepatitis C vírussal fertőzöttek számát, mely jelentős pandémiát jelent, mivel ez az össznépesség kb. 3%-a.
Magyarország lakosságának 0,7%-a, mintegy 70 000 ember lehet fertőzött hepatitis C vírussal (HCV), közülük körülbelül 50 000-re becsülhető a biztosan fertőzőképes HCV-RNS-pozitív egyének száma. Az érintettek többsége nem tud fertőzöttségéről. A fertőzöttek legnagyobb része vagy 1993 előtt kapott transzfúzióval vagy más egészségügyi beavatkozással fertőződött. A véradók szűrése (1992 óta) jelentősen csökkentette az infekció átvitelének gyakoriságát a korábbi 17%-ról a jelenlegi 0,001%-ra, de az új esetek megjelenése folyamatos, elsősorban az intravénásan alkalmazott kábítószerek elterjedtsége, valamint az egyéb parenterális átviteli lehetőségek miatt. A hazai fertőzöttek több mint 95%-ánál 1. genotípus (főleg 1b) mutatható ki.
Bizonyos fokozottan veszélyeztetett populációkban az előfordulás magas: politranszfundáltaknál (hemofiliások között) 50-80%, hemodializáltaknál 30-40%, intravénás droghasználók esetében 30-90% a HCV szeropozitívak aránya. A krónikus májbetegeknél, cirrhosisban és hepatocellularis carcinomában szenvedőknél a HCV antitest pozitivitás igen magas, 20-90%. A fertőzés forrása a viraemiás beteg vagy hordozó. Az intravénás kábítószert használók közös tű- és fecskendő használata eredményezi az érintettek magas HCV-prevalenciáját. A fertőzés eredete a betegek 20-50%-ában nem deríthető ki. HCV pozitivitást jelezhet a cryoglobulinaemia is. A HCV pozitív személyek többsége az 1945-1970 között született korosztályban található.
2.1. Rizikócsoportot képeznek
2.1.1. az egészségügyi dolgozók,
2.1.2. az 1993 előtt transzfúzióban részesültek,
2.1.3. a hemodializáltak,
2.1.4. a vérkészítményben részesülők,
2.1.5. a tetováltak, piercinget viselők,
2.1.6. a fogvatartottak,
2.1.7. a fertőzöttek szexuális partnerei és
2.1.8. egyes bőrbetegségekben szenvedők (például porphyria cutanea tarda).
A krónikus C-hepatitis spontán remissziója és gyógyulása gyakorlatilag nem fordul elő. A betegek jelentős részénél a krónikus gyulladást (annak aktivitásától függetlenül) fibrosis kíséri. Ennek gyorsasága és mértéke nagy egyéni különbségeket mutat, de ez szabja meg a beteg sorsát. A cirrhosis kialakulása átlag 20-25 év alatt következik be, majd a cirrhosis kialakulása után a betegekben HCC jelentkezik évente 3-5%-os gyakorisággal.
A progressziót gyorsítja a rendszeres alkoholfogyasztás, a haemochromatosis, a társfertőzés egyéb hepatitisvírussal. Az alkoholos cirrhosis HCV fertőzésben az alkohol elhagyása után is progrediálhat. Kompenzált HCV-cirrhosis hirtelen fulmináns dekompenzációját okozhatja akut HAV fertőzés. HIV pozitív betegben az AIDS lefolyását a krónikus C-hepatitis enyhe formája is gyorsítja, valamint HIV fertőzés mellett a hepatitis progressziója is gyorsabb. A progresszió gyorsabb túlsúlyos betegekben (27 feletti testtömeg-index). Szervtranszplantált betegeknél az akut szakasz súlyosabb, majdnem mindig krónikussá válik, és a progresszió rapid. A prognózis összefüggése a HCV vírustiter nagyságával még nem kellően bizonyított.
3. Szűrés, diagnózis
3.1. Szűrés, rizikócsoportok
Anti-HCV-vizsgálat szükséges mindazoknál, akiknél májbetegség gyanúja merül fel a klinikum vagy a laboratóriumi, illetve képalkotó vizsgálatok alapján. Szűrendő minden személy, akinél magas a HCV-fertőzés rizikója. Szűrővizsgálatként az anti-HCV 3. generációs enzimimmunoassay (EIA), annak kétes vagy pozitív eredménye esetén ELISA végzendő. Pozitív vagy kétes eredmény esetén HCV RNS PCR-vizsgálat végzése indokolt.
3.2. Diagnózis, indikáció
A hepatitis C vírus diagnózisának feltételei: anti-HCV-ellenanyag és a virális nukleinsav (HCV-RNS), valamint a májkárosodás kimutatása kóros transzaminázok (GPT/ALT) és májbiopszia vagy tranziens elasztográfia (pl. FibroScan vizsgálat), vagy mindkét előbbi ellenjavallata, kivitelezhetetlensége, elérhetetlensége esetén más, validált, nem invazív vizsgálómódszer alapján (például ELF-teszt). Ellenjavallatok hiányában, és ha azt a beteg elfogadja, kimutatható HCV-RNS és biokémiai, szövettani vagy nem invazív módszerrel igazolható, HCV-hez köthető gyulladásos aktivitás vagy fibrosis esetén antivirális kezelés indokolt.
3.2.1. Májbetegség igazolása
Igazolhatóan 6 hónapnál régebben fennálló HCV-fertőzöttség esetén az aktív hepatitis fennállását a kezelés megkezdése előtti egyetlen emelkedett GPT/ALT érték is támogatja, de normál GPT/ALT érték sem zárja azt ki, ha a májgyulladás szövettannal vagy más módszerrel igazolható (aktivitás vagy fibrosis). Megelőző icterus vagy ismert dátumú expozíció után 8-12 hét múlva is perzisztáló HCV-RNS pozitivitás esetén a krónikussá válás valószínűsége nagy, korai antivirális terápia javasolt.
Májbiopszia végzendő, ha azt a kezelőorvos szükségesnek tartja a máj necroinflammatiójának vagy a fibrosis stádiumának meghatározására, differenciáldiagnosztikai vagy prognosztikus céllal vagy a kezelésre vonatkozó döntéshez.
A fibrosis megítélése szempontjából a májbiopsziát tranziens elasztografia (FibroScan) vizsgálat vagy mindkét módszer ellenjavallata, kivitelezhetetlensége, elérhetetlensége esetén más validált nem invazív vizsgálómódszer helyettesítheti (például Shear Wave elasztográfia, ELF-teszt).
Szövettani aktivitás vagy fibrosis jelenléte normális GPT/ALT esetén is indokolja a kezelést, ha annak egyéb feltételei adottak. HCV G2 és G3 genotípusok esetén mellőzhető a májbiopszia és a nem invazív fibrosisvizsgálat.
A májbetegség és a kezelhetőség pontosabb megítéléséhez GOT (AST), GGT, ALP, se. albumin, bilirubin, protrombin, vesefunkciók (kreatinin, eGFR), teljes vérkép és hasi ultrahang- (UH-)vizsgálat (és ha ez alapján vagy emelkedett AFP érték alapján gócos májbetegség/HCC gyanúja merül fel, CT vagy MR vizsgálat) is szükséges.
A terápia előtti (0. heti: a kezelés megkezdése előtt 6 hónapon belül elvégzett), valamint terápia alatti szenzitív kvantitatív HCV-RNS vizsgálatokat valós idejű PCR-technikával, CE-IVD minősítésű, kellő érzékenységű tesztekkel az alábbi módszertani és minőségi feltételeknek megfelelően szükséges végezni:
a) alacsony detekciós limit valamennyi genotípus esetén (±5%): DL≤15 NE/ml;
b) lineáris kvantifikációs tartomány 15NE/ml-108 NE/ml között.
A PegIFN+RBV+PI vagy interferonmentes kezelés megkezdése előtt HCV-genotípus és -szubtípus meghatározása szükséges minden olyan betegnél, akinél a genotípus nem ismert, a HCV-RNS kimutatható, és a beteg kezelése szükségessé válhat.
Olyan anti-HCV-pozitív betegnél, akinél antivirális kezelés biztosan nem végezhető (például kontraindikált vagy a kezelést a beteg dokumentáltan nem vállalja), HCV-RNS és genotípus meghatározása nem indokolt.
4. A kezelések engedélyezése
Kezelési engedély csak az erre a célra létrehozott Hepatitis Regiszter (HepReg) rendszerben elektronikusan benyújtott kérelmek alapján adható ki.
A kezelések engedélyezéséről az NEAK dönt a Hepatitis Terápiás Bizottság javaslata, valamint a kezelési kérvény Prioritási Indexe alapján, a rendelkezésre álló költségvetési források, illetve a mindenkor rendelkezésre álló gyógyszer-keretek figyelembevételével.
4.1. Prioritási Index definíciója, célja
4.1.1. A Prioritási Index a májfibrosis mértékén alapuló, a májkárosodás súlyosságát és szövődményeit, a betegség aktivitását, progresszióját, az átvitel veszélyét, és további meghatározott speciális szempontokat is figyelembe vevő, a HCV-fertőzött betegek kezelésbe vonásának szakmailag indokolt sorrendjét meghatározó numerikus érték, amelynek célja, hogy orientálja a kezelőorvosokat a kezelésre szorulók ütemezését illetően, mind a kérvények benyújtásakor, mind pedig az engedélyezett kezelések megkezdésekor.
4.1.2. Objektív komponensei:
4.1.2.1. a májbetegség/fibrosis/Child-Pugh stádiuma,
4.1.2.2. a májbetegség aktivitása,
4.1.2.3. a májbetegség progressziójának üteme.
4.1.3. Szubjektív komponensei:
4.1.3.1. a kezelőorvos megítélése szerinti prioritási pontok,
4.1.3.2. a Hepatitis Terápiás Bizottság által adható prioritási pontok.
4.1.4. Speciális szempontok:
4.1.4.1. szervtranszplantált/transzplantációra váró betegek,
4.1.4.2. hemophiliás/vérzékeny betegek kezelési prioritását reprezentáló pontok (ekkor csak eredménytelen/elérhetetlen nem-invazív vizsgáló módszer esetén adható),
4.1.4.3. foglalkozással, foglalkoztathatósággal, gyermekvállalással és egyéb speciális szemponttal összefüggő pontok,
4.1.4.4. interferonmentes kezelésekhez kapcsoló speciális pontok.
4.2. Prioritási Index számítása
A Prioritási Index az alábbi pontok alatt felsorolt paraméterekhez tartozó pontszámok numerikus összege:
4.2.1. Stádium szövettan, FibroScan vagy más non-inazív teszt alapján (maximum 70 pont)
4.2.1.1. A májbiopsziát (szövettant) FibroScan helyettesítheti, vagy mindkettő ellenjavallata/kivitelezhetetlensége/elérhetetlensége esetén más validált nem-invazív vizsgáló módszer (pl. FibroTest, ELF teszt) helyettesítheti
4.2.1.2. Metavir/Knodell/FibroScan/FibroTest/Shear Wave elasztográfia/ELF teszt F0-F4 szerint 0-4×10 pont (maximum 40 pont)
4.2.1.2.1. Átmenetek: F0/F1, F1/F2, F2/F3, F3/F4 esetén sorrendben 5-15-25-35 pont
4.2.1.3. Ishak fibrosis score értékelése: 1: 10 pont, 2: 15 pont, 3: 20 pont, 4: 30 pont, 5: 35 pont, 6: 40 pont
4.2.1.4. Ha egyik vizsgálat eredménye sem áll rendelkezésre, akkor 10 pont
4.2.1.5. Plusz pontok előrehaladott cirrhosis miatt liver stiffness alapján Child A stádiumú betegnél (maximum 30 pont)
4.2.1.5.1. Fibroscan eredmény 18,0-32,9 kPa között 5 kPa-onként +5 pont
4.2.1.5.2. Fibroscan eredmény 32,9 kPa felett 10 kPa-onként +5 pont
4.2.1.6. Child-Pugh B vagy C stádium: 70 pont
4.2.2. Aktivitás, progresszió üteme (maximum 8 pont)
4.2.2.1. Az alábbiak közül a nagyobbik (maximum 4 pont)
4.2.2.1.1. HAI vagy Ishak aktivitás: 3-6 = 1 pont, 7-9 = 2 pont, 10-12 = 3 pont, 13-tól = 4 pont
4.2.2.1.2. METAVIR aktivitás: A1 = 1 pont, A2 = 2 pont, A3 = 3 pont, A4 = 4 pont
4.2.2.1.3. Progresszió elasztográfia alapján: ∆1-1,99 kPa = 1 pont, ∆2-2,99 kPa = 2 pont, ∆3 kPa = 4 pont
4.2.2.1.4. Progresszió szövettannal (∆F stádium) ∆F1 = 1 pont, ∆F2 = 2 pont, ∆F3 = 3 pont, ∆F4 = 4 pont
4.2.2.2. Utolsó GPT (NE/ml) érték/50 = pontszám (maximum 4 pont)
4.2.3. Speciális pontok
4.2.3.1. Transzplantáció miatti plusz pontok (bármely szerv transzplantációja esetén):
4.2.3.1.1. Transzplantációs listán lévő vagy HCV-fertőzöttség miatt transzplantációs programból kizárt beteg: 50 pont
4.2.3.1.2. Élő donoros transzplantációra váró beteg: 20 pont
4.2.3.1.3. Transzplantáción átesett beteg, fibrosis stádiumtól függetlenül: 50 pont
4.2.3.1.4. Transzplantáción átesett betegben fibrotizáló cholestaticus hepatitis: 80 pont
4.2.3.1.5. Haemophíliás beteg: 20 pont
4.2.3.1.6. Dializált beteg (hemodialízis vagy peritoneális dialízis): 20 pont
4.2.3.1.7. Különleges egyéb epidemiológiai indok (indoklással, pl. intézeti elhelyezés): 10 pont
4.2.3.1.8. In vitro fertilitási programban részt vevő beteg: 50 pont
4.2.3.1.9. HCV eradikálása után gyermeket vállalni szándékozó 30 év feletti gyermektelen nőbeteg: 20 pont (a kezelésre szoruló nyilatkozatát csatolni szükséges)
4.2.3.1.10. Súlyos extrahepatikus HCV manifestatio (pl. cryoglobulinaemias vasculitis, glomerulonephritis, súlyos polyarthritis, porphyria cutanea tarda, lichen ruber planus): 20 pont
4.2.3.1.11. HCV-fertőzöttség miatt foglalkozása gyakorlásától jogszabályban eltiltott személy: 50 pont
4.2.3.1.12. Betegellátásban vagy humán minták kezelésében aktívan részt vevő személy: 30 pont
4.2.3.1.13. Minden további korábbi vagy jelenlegi egészségügyi dolgozó: 15 pont
4.2.3.1.14. HCV asszociált non-Hodgkin lymphoma: 50 pont
4.2.3.1.15. Hepatocellularis carcinoma (HCC) sikeres sebészi vagy ablációs kezelésén átesett, onkoteam alapján tumormentesnek tekinthető beteg: 50 pont
4.2.3.1.16. HIV vagy HBV koinfectio: 20 pont
4.2.4. Interferon mentes kezelésekhez kapcsolódó speciális pontok
4.2.4.1. Thrombocyta 70-89 G/L esetén: 5 pont
4.2.4.2. Thrombocyta <70 G/L esetén: 10 pont
4.2.4.3. Szérum albumin 30-34 g/L esetén: 5 pont
4.2.4.4. Szérum albumin <30 g/L esetén: 10 pont
4.2.4.5. Esophagus varicositas G1-2 esetén: 5 pont
4.2.4.6. Esophagus varicositas >G2 esetén: 10 pont
4.2.4.7. Korábban Child-Pugh B vagy C stádium vagy varixvérzés esetén: 15 pont
4.2.5. Automatikusan nem értékelhető egyéb szempontok (maximum 12 pont)
4.2.5.1. Kezelőorvos pontja: maximum 2 pont (indoklás szükséges)
4.2.5.2. Hepatitis Terápiás Bizottság pontja: maximum 10 pont (indoklás szükséges)
4.2.6. A Prioritási Index a kezelésre várakozás alatt (az ezirányú kérvény benyújtását követően havonta 1 ponttal növekszik).
5. Terápiás lehetőségek
Alapvető megfontolások:
A NEAK a szakmai igények figyelembevételével dönt arról, hogy a rendelkezésére álló költségvetési forrásokat miként osztja el az egyes terápiás lehetőségek között. Ennek következtében előfordulhat, hogy egy adott időszakban a jelen finanszírozási eljárásrendben szereplő terápiák nem mindegyike érhető el a klinikai gyakorlatban. Tartós vírusválasz (SVR) megítélésére a HCV-RNS negatívvá vált betegeknél a kezelés befejezése után 24 héttel HCV-RNS vizsgálat szükséges.
Bármely STOP-szabály hatálya alá eső beteg számára csak a korábbinál igazoltan hatékonyabb gyógyszeres kezelés rendelhető.
A kezelés előtt vagy alatt – fogékonyság esetén – hepatitis A és hepatitis B ellen vakcináció javasolt.
5.1. Pegilált interferon + ribavirin kezelés (PR kettős kezelés)
5.1.1. A PegIFN és ribavirin adagolását, valamint a mellékhatás miatti dóziscsökkentésre vonatkozó szabályokat a készítmények alkalmazási előírásai ismertetik.
A két különböző PegIFN egymással történő helyettesíthetőségével kapcsolatban nem állnak rendelkezésre adatok, ezért nem ajánlott.
5.1.2. Az algoritmus részletezése
5.1.2.1. A kezelés 4. hetét követően HCV-RNS vizsgálatot kell végezni.
5.1.2.2. Ha a 4. héten a HCV-RNS nem mutatható ki (negatív), a kettős kezelést kell tovább folytatni. Alacsony kiinduló vírus titerszám esetén (<400 000 IU/ml), ha nem áll fenn cirrhosis, 24 hetes PR kettős kezelés elegendő.
5.1.2.3. Ha a 4. héten végzett HCV PCR alapján a kiinduló vírusszám csökkenése nagyobb, mint 1 log10, a PR kettős kezelést tovább kell folytatni.
5.1.2.4. A kezelés 12. hetét követően HCV-RNS vizsgálatot kell végezni. Ha ekkor a HCV-RNS kimutatható (pozitív), a PR kettős kezelést le kell állítani STOP-szabály alapján. Ha a kezelés 12. hetében HCV-RNS nem mutatható ki (negatív), PR kettős kezelést kell tovább folytatni még 12 vagy 36 héten át. A kezelés időtartama összesen 48 hét.
5.1.2.5. HCV G2- vagy HCV G3-monoinfekcio eseten a naiv-nak minősülő betegek PR kettős kezelésének időtartama 24 hét, az alábbi kivételekkel:
5.1.2.5.1. ha a kezelés megkezdését megelőzően végzett PCR-vizsgálat alacsony kiinduló vírusszintet igazol (HCV-RNS ≤800 000 NE/ml) és a HCV-RNS 4 hét kezelés után nem mutatható ki, a G2-betegekben a kettős kezelés 16 hétig tart,
5.1.2.5.2. ha a HCV-RNS 4 hét PR kettős kezelés után kimutatható, a terápia meghosszabbítása indokolt 48 hétre.
5.1.2.6. Minden sikeresen befejezett terápia után 24 héttel HCV PCR vizsgálat elvégzése (kontroll) szükséges a tartós vírusválasz megítélésére.
5.2. Interferonmentes terápiák
5.2.1. Dasabuvir + ombitasvir/paritaprevir/ritonavir (ABT3D) + ribavirin kombinációs kezelés
5.2.1.1. A dasabuvir+ombitasvir/paritaprevir/ritonavir (ABT3D) + ribavirin kombinációs kezelés 1a és 1b genotípus esetén alkalmazható, kompenzált cirrhosis fennállása esetén vagy cirrhosis nélküli betegeknek, beleértve a HIV társfertőzötteket, a végstádiumú vesebetegeket és a dializáltakat is (eGFR <30 ml/min).
5.2.1.2. 1b genotípus esetén (1), ha cirrhosis nem áll fenn, az ABT3D kombináció ribavirin nélkül adható. A kezelés időtartama 12 hét. (3) Naiv, cirrhosisban nem szenvedő, F0-F2 stádiumú betegek esetében a kezelés időtartama 8 hét.
5.2.1.3. 1b genotípus esetén, ha kompenzált cirrhosis fennáll, ABT3D + ribavirin kombinációs kezelés adható. A kezelés időtartama 12 hét. (4)
5.2.1.4. 1a genotípus esetén (2), ha cirrhosis nem áll fenn, ABT3D + ribavirin kombinációs kezelés adható. A kezelés időtartama 12 hét. (4)
5.2.1.5. 1a genotípus esetén, ha kompenzált cirrhosis fennáll, ABT3D + ribavirin kombinációs kezelés adható. A kezelés időtartama 24 hét. (5)
5.2.1.6. Szervtranszplantáltaknál, ABT3D + ribavirin kombinációs kezelés adható. A kezelés időtartama 24 hét.
5.2.1.7. G4-beteg esetében Paritaprevir/ritonavir + ombitasvir (ABT2D) + RBV kombináció javasolt, korábban nem kezelt, nem cirrhosisos betegek kezelésére. A kezelés időtartama cirrhosis nélkül 12 hét, kompenzált cirrhosisos betegeknél 24 hét.
5.2.1.8. Vesebetegek esetében <30 ml/min eGFR esetén is adható, beleértve a dializált betegeket is.
5.2.1.9. Az ABT3D/ABT2D kombinációval végzett kezelés során nincsen STOP-szabály, ezért kezelés közben a HCV-RNS-szint monitorozása nem szükséges.
5.2.1.10. Minden sikeresen befejezett terápia után 24 héttel HCV PCR vizsgálat elvégzése (kontroll) szükséges a tartós vírusválasz megítélésére.
5.2.2. Ledipasvir + sofosbuvir ± ribavirin kombinációs kezelés
A ledipasvir (LDV) a sofosbuvirral (SOF) fix dózisú kombinációban törzskönyvezett készítmény.
5.2.2.1. Cirrhosisban nem szenvedő G1-, G4-, G5- vagy G6-fertőzött betegeknél a kezelés időtartama 12 hét, ribavirin nélkül.
5.2.2.2. 8 hetes kezelés javasolt cirrhosisban nem szenvedő, G1 genotípusú vírussal fertőzött, korábban nem kezelt olyan betegeknél, akiknél 6 millió NE/ml alatti a kiinduló vírusszám (kivéve a szervtranszplantáción átesetteket).
5.2.2.3. Kompenzált vagy dekompenzált cirrhosisban szenvedő, vagy korábban PR kettős kezeléssel sikertelenül kezelt G1- vagy G4-fertőzött betegeknél a kezelés kiegészítése szükséges RBV-vel. A kezelés időtartama 12 hét. Ribavirin ellenjavallat vagy intolerancia esetén a kezelési idő 24 hét.
5.2.2.4. G3 genotípussal fertőzött cirrhosisban szenvedő betegeknél a kezelés RBV-vel egészítendő ki. A kezelés időtartama 24 hét.
5.2.2.5. Az LDV+SOF kombinációval végzett kezelés során nincsen STOP-szabály, ezért kezelés közben a HCV-RNS-szint monitorozása nem szükséges.
5.2.2.6. Minden sikeresen befejezett terápia után 24 héttel HCV PCR vizsgálat elvégzése (kontroll) szükséges a tartós vírusválasz megítélésére.
5.2.3. Elbasvir + grazoprevir ± ribavirin kombinációs kezelés
Az elbasvir + grazoprevir kombinációs kezelés 1a, 1b és 4-es genotípus esetén alkalmazható. HIV társfertőzés esetén és végstádiumú vesebetegek esetében <30 ml/min eGFR esetén is adható, beleértve a dializált betegeket is.
5.2.3.1. 1b genotípus esetén a kezelés időtartama 12 hét, ribavirin nélkül. Ha a beteget korábban sikertelenül kezelték PI kezeléssel, ribavirinnel kombinálva adandó.
5.2.3.2. 1a és G4 genotípus esetén az elbasvir/grazoprevir + ribavirin kezelés időtartama 16 hét.
5.2.3.3. Az elbasvir + grazoprevir kombinációval végzett kezelés során nincsen STOP-szabály, ezért a HCV-RNS-szint monitorozása nem szükséges.
5.2.3.4. Minden sikeresen befejezett terápia után 24 héttel HCV PCR vizsgálat elvégzése (kontroll) szükséges a tartós vírusválasz megítélésére.
5.2.4. Daclatasvir + simeprevir ± ribavirin kombinációs kezelés
A daclatasvir + simeprevir kombinációs kezelés 1b genotípus esetén mérlegelendő.
5.2.4.1. A kezelés megkezdése előtt polimorfizmus vizsgálata indokolt. NS5A-L31 vagy NS5A-Y93 RAV küszöbérték (10%) feletti jelenléte esetén a kombináció nem adható.
5.2.4.2. Naiv-nak minősülő G1b-betegek kezelésének időtartama 24 hét, RBV nélkül.
5.2.4.3. PR kettős kezelésre nem reagáló betegek kezelésének időtartama 24 hét, RBV együttes adása szükséges.
5.2.4.4. A daclatasvir + simeprevir kombinációval végzett kezelés során nincsen STOP-szabály, ezért a HCV-RNS-szint monitorozása nem szükséges.
5.2.4.5. Minden sikeresen befejezett terápia után 24 héttel HCV PCR vizsgálat elvégzése (kontroll) szükséges a tartós vírusválasz megítélésére.
5.2.5. Daclatasvir + sofosbuvir ± ribavirin kombinációs kezelés
A daclatasvir + sofosbuvir G1, G3 vagy G4 genotípussal fertőzött betegeknek adható.
5.2.5.1. G1- vagy G4-fertőzött nem cirrhosisos betegekben a kezelés időtartama 12 hét, kompenzált cirrhosisos betegekben 24 hét, ribavirin együttes adása nem szükséges.
5.2.5.2. Korábbi PI kezelésre nem reagáló betegeknél a kezelés időtartamának meghosszabbítása mérlegelendő 24 hétre, ribavirin együttes adása nem szükséges.
5.2.5.3. G3 genotípus esetén kompenzált cirrhosisos vagy korábban PI-kezelésben részesült betegek esetében a kezelés időtartama 24 hét, ribavirinnel kombinálva.
5.2.5.4. A daclatasvir + sofosbuvir kombinációval végzett kezelés során nincsen STOP-szabály, ezért a HCV-RNS-szint monitorozása nem szükséges.
5.2.5.5. Minden sikeresen befejezett terápia után 24 héttel HCV PCR vizsgálat elvégzése (kontroll) szükséges a tartós vírusválasz megítélésére.
5.2.6. Sofosbuvir + simeprevir ± ribavirin kombinációs kezelés
5.2.6.1. A sofosbuvir + simeprevir G1 vagy G4 genotípussal fertőzött betegeknek adható.
Korábban nem kezelt vagy korábbi PR kettős kezeléssel sikertelenül kezelt cirrhosisos vagy nem cirrhosisos betegeknél a kezelés időtartama egyaránt 12 hét ribavirin adása mellett.
5.2.6.2. G1-fertőzött betegek kezelésekor ribavirin adása nem szükséges, de G1a vagy kedvezőtlen prediktorok (beleértve a PR kezelésre null-reagáló betegeket) esetén adása indokolt lehet.
5.2.6.3. A sofosbuvir + simeprevir kombinációval végzett kezelés során nincsen STOP-szabály, ezért a HCV-RNS-szint monitorozása nem szükséges.
5.2.6.4. Minden sikeresen befejezett terápia után 24 héttel HCV PCR vizsgálat elvégzése (kontroll) szükséges a tartós vírusválasz megítélésére.
5.2.7. Sofosbuvir + ribavirin kombinációs kezelés
Terápia-naiv-nak minősülő vagy PR kettős kezeléssel sikertelenül kezelt HCV G2-vel fertőzött kompenzált vagy dekompenzált cirrhosisos vagy nem cirrhosisos beteg: 12 hetes Sofosbuvir + ribavirin kezelés.
Megfontolandó a terápia időtartamának legfeljebb 24 hétre történő meghosszabbítása, ha több olyan tényező áll fenn, amely a korábbiakban az interferon alapú terápiákkal szembeni alacsonyabb válaszarányokkal járt együtt (például előrehaladott fibrosis/cirrhosis, magas kiindulási vírustiter, fekete rassz, IL28B, nem CC genotípus, a terápiás válasz hiánya a korábbi peginterferon alfa és ribavirin kezelés során).
5.2.8. sofosbuvir+velpatasvir kombinációs kezelés
A velpatasvir (VEL) a sofosbuvirral (SOF) fix dózisú kombinációban törzskönyvezett készítmény.
5.2.8.1. A kezelés hossza valamennyi genotípus esetén (G1-G6) 12 hét, cirrhosisban nem szenvedő illetve kompenzált cirrhosisban szenvedő betegek esetében ribavirin hozzáadása nélkül.
5.2.8.2. Dekompenzált cirrhosisban szenvedő betegek esetében a 12 hetes sofosbuvir+velpatasvir kezelés ribavirinnel kiegészítendő. G3 genotípus esetében a ribavirin hozzáadása megfontolandó.
5.2.8.3. Korábban már NS5A gátló hatóanyagot tartalmazó sikertelen terápiában részesült betegek esetében megfontolható a sofosbuvir+velpatasvir kezelés + ribavirin 24 héten át.
5.2.8.4. Minden sikeresen befejezett terápia után 24 héttel HCV PCR vizsgálat elvégzése (kontroll) szükséges a tartós vírusválasz megítélésére.
6. Speciális esetek
6.1. HCV korai kezelése
Megelőző icterus vagy ismert dátumú expozíció után 8-12 hét múlva is perzisztáló HCV-RNS-pozitivitás esetén korai antivirális kezelés indokolt, 24 hetes PegIFN-monoterápiával. A kezelés 4. hetét követően is kimutatható HCV-RNS esetén a kezelés kiegészítése javasolt RBV-vel.
6.2. HCV-fertőzött várandósok és kismamák
HCV-fertőzött várandósok és kismamák kezelése a terhesség és szoptatás utánra halasztandó. HCV-fertőzött anyáknál az elektív császármetszés nem véd a HCV-fertőzés átvitele ellen, ezért preventív császármetszés nem indokolt.
Szoptatással történő transzmisszióra nincs evidencia, ezért a HCV-fertőzött kismama szoptathat. Ugyanakkor a szoptatás felfüggesztése megfontolandó, ha a mellbimbó bereped, illetve vérzik.
HCV-fertőzött anya gyermekénél a szűrés 18 hónapos korban javasolt.
6.3. Gyermekek
Hároméves kor felett indokolt esetben gyermekgyógyász és hepatológus együttes javaslata alapján 48 hetes PR kettős kezelés javasolható. Dozírozás az alkalmazási előírás szerint. 18 éves kor alatt PI alkalmazása tapasztalat hiányában nem megengedett.
6.4. Extrahepaticus manifesztációk
Az extrahepaticus manifesztációk közül egyértelmű kezelési prioritást élvez a cryoglobulinaemiás vasculitis, a glomerulonephritis, a súlyos polyarthritis, a porphyria cutanea tarda, a lichen ruber planus és a non-Hodgkin lymphoma (NHL).
NHL esetén hematológus és hepatológus együttes véleménye alapján dönthető el, hogy melyik betegség kezelése történjen elsőként.
6.5. Pozitív addiktológiai anamnézisű és pszichiátriai betegek
A kábítószer-használók körében világszerte növekszik a HCV-fertőzöttek száma. Kábítószert jelenleg vagy a közelmúltban használó személy esetén az addiktológus véleményét figyelembe véve mérlegelhető kezelés.
Ha kábítószer használatára pozitív az anamnézis, a kombinált antivirális kezelés 3 hónapos – legalább két negatív drogteszttel igazolt – absztinencia után kezdhető meg.
A DAA készítmények megválasztásakor a gyógyszer-interakciók figyelembevétele szükséges.
IFN-kezelés megkezdése előtt a manifeszt pszichiátriai zavar (különös tekintettel a depresszióra és a szorongásos kórképekre) kizárása szükséges, pszichiátriai javaslattal, szoros pszichiátriai ellenőrzés mellett kezdhető meg a kezelés.
6.6. HCV-HBV társfertőzés
A HCV kezelése alatt vagy után a HBV-infekció fellángolhat, emiatt szoros monitorozás indokolt.
A HBV-társfertőzött CHC-s betegeket a HCV-monoinfekció szabályai szerint kell kezelni.
6.7. HIV-HCV társfertőzés
Aktív retrovirális kezelés, illetve <200/μl CD4 sejtszám esetén fokozott ellenőrzés indokolt a tejsavacidosis, illetve a cytopenia lehetősége miatt.
IFN-mentes kezelés a HIV-társfertőzés nélküli HCV-nek megfelelően végezhető.
6.8. Haemoglobinopathiák
A kezelés indikációja megegyezik a haemoglobinopathiában nem szenvedő HCV-fertőzöttekével. A jelentős anaemizálódási hajlam miatt IFN- és RBV-mentes kezelés előnyben részesítendő.
6.9. Krónikus veseelégtelenség
Krónikus vesebetegeknél a kezelési mód megválasztása a szérumkreatinin-szinttől és a kreatininclearancetől vagy a becsült glomeruláris filtrációs rátától (eGFR) függ.
Peg-IFN-alfa-2a+RBV kombinált kezelés – megfelelő monitorozás mellett, dóziscsökkentéssel – beszűkült vesefunkciók esetén is végezhető.
Peg-IFN-alfa-2b+RBV 200 μmol/l feletti kreatinin vagy 50 ml/perc alatti kreatininclearance esetén ellenjavallt.
Peg-IFN-alfa-2b-monoterápia végezhető beszűkült vesefunkció esetén (15-50 ml/perc kreatininclearance) az alkalmazási előírásban rögzített dóziscsökkentéssel.
Enyhe és középsúlyos veseelégtelenségben a SOF+LDV kombináció biztonsággal adható.
Az ABT3D±RBV kombinációval kevés, de biztató adat áll rendelkezésre; előrehaladott vesebetegségben is biztonságosnak tűnik.
A grazoprevir + elbasvir kombinációt hatékonynak és biztonságosnak találták előrehaladott vesebetegségben is – ribavirin adása nélkül.
A ribavirin – ha szükséges – csökkentett dózisban adható (napi 1×200 mg vagy heti 3×200 mg). Kifejezett óvatosságra van szükség.
Hemodializált betegek kombinált antivirális kezelése egyedi mérlegelés alapján elsősorban akkor indokolt, ha a beteg vesetranszplantációra is esélyes.
6.10. Szervtranszplantáció (kivéve májátültetés)
Szervtranszplantáció (kivéve májátültetés) után csak IFN-mentes kombináció adása javasolható, a kezelés mindenképpen indokolt és prioritást élvez.
Az esetleges gyógyszerinterakciók körültekintő értékelésével egyedi mérlegelés szükséges. SOF, LDV vagy DCV esetén sem a tacrolimus, sem a cyclosporin A adagjának módosítása nem szükséges. SIM és cyclosporin A együtt adása nem javasolható.
Szervtranszplantáltak HCV kezelése olyan intézményben végzendő, ahol az immunszuppresszív szerek (cyclosporin, tacrolimus) koncentrációját egyidejűleg monitorozni lehet.
6.11. Májtranszplantáltak (Májtranszplantáció utáni HCV rekurrencia kezelése)
Májtranszplantált betegeknél kialakuló új HCV-fertőzés (vagy rekurrencia) a rejekció lehetőségének kizárását követően korán kezelendő, mindenképpen indokolt és prioritást élvez.
A DAA készítmények potenciális interakciói fokozott figyelmet igényelnek.
Májtranszplantáltak HCV kezelése olyan intézményben végzendő, ahol az immunszuppresszív szerek (cyclosporin, tacrolimus) koncentrációját egyidejűleg monitorozni lehet.
7. A finanszírozási ellenőrzés alapját képező ellenőrzési sarokpontok
7.1. Az interferon terápia előtt a szükséges diagnosztikai kritériumok teljesültek-e?
7.2. A betegek beválogatása a Hepatitis Terápiás Bizottság engedélye alapján és a Prioritási Indexnek megfelelően történt-e?
7.3. Történt-e májbiopszia, transiens elastographia vagy más validált nem-invazív módszer a fibrosis stádiumának meghatározására normál GPT esetén?
7.4. A kezelés előtt minden betegnél történt-e PCR vizsgálat?
7.5. A gyógyszeres terápia hossza a beteg labor eredményei alapján alátámasztott és dokumentált-e?
7.5.1. Az algoritmus szerinti időpontokban a szükséges vírusvizsgálat megtörtént-e?
7.5.2. A kezelés hossza ennek megfelelő volt-e?
7.6. A terápia befejezését követően legalább 24 héttel PCR vizsgálat történt-e?
7.7. Az interferonmentes terápiák megkezdése előtt megtörtént-e a genotípus meghatározása?
8. A finanszírozási eljárásrend alkalmazásának hatását mérő minőségi indikátorok
8.1. A területre fordított közkiadások alakulása
8.2. A finanszírozott algoritmus szerint kezelt betegek aránya
9. A finanszírozás szempontjából lényeges kódok
9.1. Releváns BNO kódok
BNO |
BNO megnevezés |
B1820 |
Idült vírusos C-típusú hepatitis |
9.2. OENO kódok
OENO |
OENO megnevezés |
11041 |
Vizsgálat |
88460 |
Vérvétel |
99910 |
Kiegészítő pont veszélyeztető beteg ellátásáért |
28014 |
Vérkép automatával IV. |
24600 |
Aszpartát-amino-transzferáz (ASAT, GOT) meghatározása |
24610 |
Alanin-amino-transzferáz (ALAT, SGPT) meghatározása |
24640 |
Gamma-glutamil-transzferáz meghatározása |
24720 |
Alkalikus foszfatáz meghatározása |
24741 |
Pszeudo-kolineszteráz meghatározása |
21020 |
Összfehérje meghatározása szérumban |
21040 |
Albumin meghatározása szérumban, festékkötő módszerrel |
21310 |
Glükóz meghatározása |
21420 |
Összkoleszterin meghatározása |
21411 |
Trigliceridek meghatározása |
21150 |
Összes bilirubin meghatározása szérumban |
21151 |
Konjugált bilirubin meghatározása szérumban |
28620 |
Prothrombin meghatározása |
21120 |
Karbamid meghatározása szérumban |
21140 |
Kreatin meghatározása |
2627T |
Hepatitis C vírus AT kimutatása |
2639A |
HBsAg AG kimutatása |
26261 |
HIV AT kimutatása |
24060 |
TSH meghatározása (Thyreoidea-Stimuláló Hormon) |
25567 |
Hepatitis C vírus kvantitatív meghatározása, molekuláris biológiai módszerrel |
25566 |
Hepatitis C vírus kvalitatív meghatározása, molekuláris biológiai módszerrel |
25569 |
HCV genotípus meghatározása molekuláris diagnosztikai módszerrel |
25572 |
Hepatitis B vírus gyógyszer-rezisztens mutánsainak meghatározása PCR alapú módszerrel |
29000 |
Szövettani vizsgálat a szokásos feldolgozási módszerrel |
36130 |
Hasi (áttekintő, komplex) UH-vizsgálat |
3613D |
Tranziens elasztográfia |
81581 |
UH vezérelt májbiopsia |
81580 |
Aspiratio hepatis |
92231 |
Immunmoduláció |
91311 |
Krónikus beteg dietetikai alapoktatása (gastroenterológiai, nephrológiai, onkológiai vagy 2. típusú diabeteses betegnél) |
9.3. HBCS kódok
HBCS |
HBCS megnevezés |
351B |
Májbetegségek, kivéve rosszindulatú daganatok, cirrhosis |
9422 |
Kiegészítő HBCs transzplantátummal élő személy ellátására |
3480 |
Májcirrhosis |
9.4. ATC kódok
ATC |
ATC megnevezés |
L03AB04 |
interferon alfa-2a |
L03AB01 |
interferon alfa természetes |
L03AB05 |
interferon alfa-2b |
L03AB11 |
peg-Interferon alfa-2a |
L03AB10 |
peg-Interferon alfa-2b |
J05AB04 |
ribavirin |
J05AE11 |
telaprevir |
J05AE12 |
boceprevir |
J05AE14 |
simeprevir |
J05AX14 |
daclatasvir |
J05AX15 |
sofosbuvir |
J05AX16 |
dasabuvir |
J05AX67 |
ombitasvir, paritaprevir, ritonavir |
J05AX65 |
ledipasvir, sofosbuvir |
J05AX68 |
elbasvir, grazoprevir |
J05AX69 |
sofosbuvir, velpatasvir |
10. Rövidítések
10.1. ALT Alanin aminotranszferáz
10.2. ATC Anatomical Therapeutic Chemical klasszifikáció
10.3. BNO Betegségek nemzetközi osztályozása
10.4. CHC Krónikus hepatitis C
10.5. GPT Glutamát-piruvát transzamináz
10.6. HBCS Homogén betegségcsoport
10.7. HCC HepatoCelluláris Carcinoma
10.8. HCV Hepatitis C vírus
10.9. OENO Orvosi eljárások nemzetközi osztályozása
10.10. PCR Polymerase Chain Reaction
10.11. PegIFN Pegilált interferon
10.12. PI Proteáz inhibitor
10.13. PR Pegilált interferon ribavirin
10.14. RVR Rapid vírusválasz
10.15. eRVR Extended rapid viral response (kiterjesztett rapid vírus válasz)
10.16. RBV Ribavirin
10.17. StdIFN Hagyományos interferon
10.18. SVR Sustained virologic response (tartós virológiai válasz)
10.19. ABT2D ombitasvir/paritaprevir/ritonavir
10.20. ABT2D ombitasvir/paritaprevir/ritonavir + dasabuvir
10.21. LDV ledipasvir
10.22. SOF sofosbuvir
10.23. SIM simeprevir
10.24. DAC daclatasvir
10.25. VEL velpatasvir
„
”
12. melléklet a 35/2018. (X. 12.) EMMI rendelethez
„4.2.5. Lenalinomid tartalmú kezelés elsősorban olyan betegek esetében javasolt, akiknek megelőző bortezomib-bázisú kezelése hatástalan volt (kisebb, mint PR) vagy a bortezomib-alapú terápia hatásos volt ugyan, de súlyos (min. CTC gr. II.) neuropathia alakult ki, és a beteg relapsusba került, vagy már a betegség felfedezésekor ilyen mértékű polyneuropathiája volt. Emellett nincsen cytogenetikai/FISH módszerrel kimutatható p53 deléciójuk (17p-), thrombocyta számuk legalább 75 ezer, abszolút neutrofil számuk legalább 1.5 G/l. A kezelés (pl. Len/dex) a betegség progressziójáig vagy intolerancia kialakulásáig folytatható.”
„4.3. A myeloma multiplex második és többedik relapszusa"
4.3.1. Amennyiben az előző vonalbeli kezelésre adott válasz hossza a várható mediánt elérte, és nincs kizáró kontraindikáció, az előző hatásos kezelés ismételhető.
4.3.2. HSCT-t követően fenntartó kezelésre 1. szintű evidencia alapján thalidomid (ha nem volt része a korábbi kezelésnek, vagy nincs kizáró neuropátia és a beteg vállalja a kumulatív dózisból adódó másodlagos neuropátia kockázatát), vagy 2B evidencia alapján válogatott betegcsoportban (rossz prognózisú betegség, nagy kockázatú citogenetika, nehezen elérhető remisszió, 60 év alatti beteg, igazolt perifériás neuropátia) interferon vagy szteroid adható.
4.3.3. A karfilzomib+dexametazon±lenalidomid kombináció ECOG 0-1 státuszú betegeknek adható harmad vagy negyedvonalban. A terápia hatásosságát 6 ciklust követően szükséges értékelni. A 6. ciklus után komplett remisszióba kerülő betegek esetén folytatható finanszírozottan a kezelés progresszióig, de legfeljebb 12 hónapig.
4.3.4. A daratumumab lenalidomiddal és dexametazonnal (DRd) vagy bortezomibbal és dexametazonnal (DVd) kombinálva harmad vagy negyedvonalban második vagy harmadik relapszust követően alkalmazható. A legnagyobb terápiás előny a DRd kombináció esetében azon betegeknél várható, akik ECOG 0-1 státuszúak, vagy azt a kezelés eredményeként várhatóan elérik, továbbá akik korábban még nem részesültek lenalidomid kezelésben. A terápia hatásosságát 3 hónap után értékelni szükséges. Azon betegek esetében folytatható tovább finanszírozottan a kezelés, akik 3 hónap után legalább parciális remisszióba kerültek.
4.3.5. A jelen anyag az allogén őssejt-transzplantáció részletes finanszírozási eljárásrendjére nem terjed ki.”
(1 |
ATC |
ATC megnevezés) |
„14 |
L01CX24 |
daratumumab |
15 |
L01XX45 |
karfilzomib” |
13. melléklet a 35/2018. (X. 12.) EMMI rendelethez
„3. NSTEMI és instabil angina finanszírozás rendje, finanszírozási algoritmus
„
„3.11.6. Az acut coronaria syndromás (NSTEMI-n átesett, instabil anginás) betegek, akiknél percutan coronaria intervenció és stent beültetés történt, és clopidogrel allergia vagy laboratóriumilag igazolt non-reszponzió vagy igazolt diabetes mellitus áll fenn vagy stent trombózist szenvedtek el, egy éven keresztül: ticagrelor hatóanyag
3.11.7. Az acut coronaria syndromás (NSTEMI-n átesett, instabil anginás) betegek közül mindazoknál, akik krónikus veseelégtelenségben szenvednek (kreatinin clearance < 60ml/perc): ticagrelor hatóanyag”
„5.2.2. A kórkép korai kezelésének megkezdése és dokumentálásának ellenőrzése
5.2.2.1. ASA+clopidogrel
5.2.2.2. ASA+ticagrelor
5.2.2.3. ASA+prasugrel
5.2.2.4. sztatin kezelés
5.2.2.5. béta-blokkoló
5.2.2.6. ACE-gátló vagy ACE-gátló intolerancia esetén ARB (csökkent balkamra funkció esetén)”
„7.4. A releváns ATC kódok
|
A |
B |
1 |
ATC |
ATC megnevezés |
2 |
B01AC06 |
acetilszalicilsav |
3 |
B01AC04 |
clopidogrel |
4 |
B01AC22 |
prasugrel |
5 |
B01AC24 |
ticagrelor |
6 |
B01AC16 |
eptifibatid |
7 |
B01AC17 |
tirofiban |
8 |
B01AB05 |
enoxaparin |
9 |
B01AB06 |
nadroparin |
10 |
C10AA01 |
simvastatin |
11 |
C10AA05 |
atorvastatin |
12 |
C10AA07 |
rosuvastatin |
13 |
C10AX09 |
ezetimibe |
14 |
C10BA05 |
atorvasztatin és ezetimibe |
15 |
C09A |
ACE-inhibitorok önmagukban |
16 |
C09B |
ACE-inhibitorok kombinációban |
17 |
C09CA |
angiotensin II antagonisták önmagukban |
18 |
C09D |
angiotensin II antagonisták kombinációi |
19 |
C07AB02 |
metoprolol |
20 |
C07AB03 |
atenolol |
21 |
C07AB07 |
bisoprolol |
22 |
C07AB12 |
nebivolol |
23 |
C07AG02 |
carvedilol |
24 |
C07BB07 |
bisoprolol+thiazidok |
25 |
C07FB02 |
metoprolol+egyéb vérnyomáscsökkentők |
”
14. melléklet a 35/2018. (X. 12.) EMMI rendelethez
„3.5. A metasztatikus prosztata daganat ellátása – metasztatikus prosztata daganat
”
„3.6.4.1. metasztatizáló, kasztráció-rezisztens prosztatarákban szenvedő felnőtt férfiak kezelésére, akiknek a betegsége docetaxel-kezelés mellett vagy azt követően progrediált és a kemoterápiát megelőzően még nem részesültek abirateron-acetát kezelésben.”
„3.6.6. Abirateron-acetát alkalmazásának feltételei:
3.6.6.1. Prekemoterápiás indikációban:
Metasztatizáló, kasztráció-rezisztens prosztatarákban szenvedő felnőtt férfiak kezelésére, akik sikertelen androgén deprivációs kezelést követően tünetmentesek vagy enyhe tüneteket mutattak, és akiknél a klinikai állapot alapján a kemoterápiás kezelés még nem indokolt, amennyiben a primer elváltozás vagy a metasztázis lokálisan nem kezelhető. Prekemoterápiás alkalmazás esetén posztkemoterápiás indikációban az abirateron- acetát és enzalutamid már nem alkalmazható. A terápia hatásosságát 3 hónapos kezelést követően értékelni szükséges.
3.6.6.2. Posztkemoterápiás indikációban:
Metasztatizáló, kasztráció-rezisztens prosztatarákban szenvedő felnőtt férfiak kezelésére, akiknek a betegsége docetaxel-kezelés mellett vagy azt követően progrediált és a kemoterápiát megelőzően még nem részesültek abirateron-acetát kezelésben, amennyiben a primer elváltozás vagy a metasztázis lokálisan nem kezelhető.
3.6.6.3. nem sebészi kasztráció esetén az LHRH-analóg adását folytatni kell”
„4.2.6. Az abirateron-acetát és enzalutamid kemoterápiához viszonyított alkalmazásának finanszírozási feltételei teljesültek-e?”
15. melléklet a 35/2018. (X. 12.) EMMI rendelethez
„3.1. A szkizofrénia antipszichotikus gyógyszeres kezelésének finanszírozási algoritmusa
A finanszírozási algoritmus részletezése
3.1.1. (1) Az első vonalban támogatott – per os és nem depo injekciós – antipszichotikus készítmények. A lépcsőn belül több gyógyszer is alkalmazható, de a választott gyógyszert monoterápiában és legalább 2 hétig kell alkalmazni. Az (1) lépcsőt legalább 6 hétig folytatni kell.
3.1.2. (2) A második vonalban támogatott – per os – antipszichotikus készítmények. Akkor választhatók, ha az (1) szerint legalább 6 hétig folytatott kezelés ellenére az antipszichotikus hatás nem volt megfelelő. A lépcsőn belül több gyógyszer is alkalmazható, de a választott gyógyszert monoterápiában és legalább 2 hétig kell alkalmazni. Kariprazin hatóanyagú készítmény akkor választható, ha a betegnél negatív tünet fennállása igazolható. A (2) lépcsőt legalább 6 hétig folytatni kell. A (2) pont szerinti kezelésről lehetőség van bármikor ismét az (1)-re lépni.
3.1.3. (3) A harmadik vonalban támogatott antipszichotikus készítmények. Akkor választhatók, ha legalább két különböző – köztük legalább egy második generációs – hatóanyagú antipszichotikus gyógyszerrel összesen legalább 12 hétig folytatott kezelés ellenére az antipszichotikus hatás nem volt megfelelő. A választott gyógyszert monoterápiában kell alkalmazni. A (3) lépcsőt legalább 10 hétig folytatni kell.
3.1.4. (4) A negyedik vonalban támogatott gyógyszeres kezelés: kettő antipszichotikum kombinációja. Akkor választható, ha a (3) pont szerint legalább 10 hétig folytatott kezelés ellenére az antipszichotikus hatás nem volt megfelelő. Az antipszichotikumok kettős kombinációban történő rendelésére kizárólag a II. vagy magasabb progresszivitási szintű pszichiátriai osztályok pszichiáter szakorvosai, valamint e szakorvosok javaslatára a kezelést végző pszichiáter szakorvosok jogosultak.
3.1.5. (5) A támogatott injekciós hosszú hatású depo készítmények. Ha az (1) szerint legalább 6 hétig tartó vagy a (2) szerint legalább 6 hétig tartó kezelésre megfelelő antipszichotikus hatás jelentkezik, de a beteg a per os kezeléssel nem kooperál megfelelően, a kezelőorvos döntése alapján választható első generációs depo készítmény. Amennyiben a nem megfelelő kooperáció miatt legalább 1, hospitalizációt igénylő relapszus következett be, a kezelőorvos döntése alapján választható első vagy második generációs depo készítmény. Második generációs depo készítmény választásának további feltétele, hogy a beteg az azonos hatóanyagú per os készítménnyel végzett kezelés alatt álljon és az antipszichotikus hatás megfelelő legyen. A választott depo készítményt monoterápiában kell alkalmazni. Amennyiben második generációs depo készítménnyel történő kezelés megkezdését követő 3 éven belül – a választott készítmény alkalmazása mellett – 2, hospitalizációt igénylő relapszus következett be, ezen készítmény tovább nem alkalmazható.
3.1.6. (6) Amennyiben a kezelés során bármikor akutan kialakuló veszélyeztető vagy közvetlen veszélyeztető állapot jelentkezik, – legfeljebb ezen állapot időtartamáig – szükség esetén átmenetileg adhatók az (1) lépcső szerinti első vonalbeli készítmények az aktuálisan alkalmazott antipszichotikus gyógyszeres kezelés kiegészítésére.”
„6.4. Releváns ATC kódok
|
A |
B |
1 |
ATC |
ATC megnevezés |
2 |
N04 |
Antiparkinson szerek |
3 |
N05A |
Antipszichotikumok |
4 |
N05AA02 |
levomepromazin |
5 |
N05AB02 |
flufenazin |
6 |
N05AD01 |
haloperidol |
7 |
N05AE03 |
sertindol |
8 |
N05AE04 |
ziprasidone |
9 |
N05AF01 |
flupentixol |
10 |
N05AF05 |
zuclopenthixol |
11 |
N05AH02 |
clozapin |
12 |
N05AH03 |
olanzapin |
13 |
N05AH04 |
quetiapin |
14 |
N05AL01 |
sulpirid |
15 |
N05AL03 |
tiaprid |
16 |
N05AL05 |
amisulprid |
17 |
N05AX08 |
risperidon |
18 |
N05AX12 |
aripiprazol |
19 |
N05AX13 |
paliperidon |
20 |
N05AX15 |
kariprazin |
21 |
N05B |
Anxiolitikumok |
”
16. melléklet a 35/2018. (X. 12.) EMMI rendelethez
„3.4. A sclerosis multiplex progressziójának/aktivitásának csökkentését célzó gyógyszeres kezelés algoritmusa
 „
„„3.5.2.1. A gyógyszer alkalmazási előírásában részletezett feltételek szerint az utóbbi meghatározott időszakban előfordult legalább a meghatározott számú jelentős klinikai relapszus.”
3. Az R3. 6.4. pontja helyébe a következő rendelkezés lép: „6.4. Releváns ATC kódok
|
A |
B |
1 |
ATC |
ATC megnevezés |
2 |
H02AB04 |
metilprednizolon |
3 |
L03AB07 |
interferon béta-1a |
4 |
L03AB08 |
interferon béta-1b |
5 |
L03AX13 |
glatiramer-acetát |
6 |
L04AA23 |
natalizumab |
7 |
L04AA27 |
fingolimod |
8 |
L04AA31 |
teriflunomid |
9 |
L04AA34 |
alemtuzumab |
10 |
L04AX01 |
azatioprin |
11 |
M03BX01 |
baclofen |
12 |
M03BX02 |
tizanidin |
13 |
M03BX04 |
tolperison |
14 |
N04BB01 |
amantadin |
15 |
N07XX09 |
dimetil-fumarát |
„
17. melléklet a 35/2018. (X. 12.) EMMI rendelethez
Az asthma bronchiale diagnosztikája és gyógyszeres kezelése felnőttkorban finanszírozási eljárásrendje
1. Az eljárásrend tárgyát képező betegség, betegcsoport megnevezése
Asthma bronchiale (BNO: J45)
Status asthmaticus (BNO: J46H0)
2. A kórkép leírása
Az asthma bronchiale a légutak krónikus gyulladásos megbetegedése. A patomechanizmus fő tényezői a gyulladás, a légutak strukturális átalakulása és a bronchiális hiperreaktivitás. A légutak obstrukcióval reagálnak nem specifikus stimulusokra. Klinikailag rendszeresen jelentkeznek nehézlégzéssel, mellkasi feszüléssel, köhögéssel járó epizódok leginkább éjszaka vagy kora reggel. A panaszok hátterében álló változó mértékű légúti szűkület spontán vagy megfelelő farmakoterápia hatására többnyire reverzibilis. Bármely súlyossági fokozatban felléphet exacerbáció, ami a jellemző tünetek (nehézlégzés, köhögés, sípoló légzés, mellkasi feszülés) fokozódása, illetve e fokozott tünetek kombinációja. Az asthma multifaktoriális etiológiájú kórkép, kialakulásában genetikai és környezeti tényezők játsszák a fő szerepet. Az európai országokban az asthma prevalenciája 5-10% körül mozog. Magyarországon a pulmonológiai szakellátásban mintegy 200 ezer beteget tartanak nyilván, az új megbetegedések száma évente 10-20 ezer. A betegség ellátása komoly terhet ró a betegre és a társadalomra egyaránt. Az asthma klinikai manifesztációi adekvát gyógyszeres kezeléssel és megfelelő gondozással jól kontrollálhatók, de maga a betegség nem gyógyítható.
A jelen finanszírozási eljárásrend hatálya a felnőttkori asthma bronchiale diagnosztikájára, valamint gyógyszeres kezelésére terjed ki.
3. A finanszírozás rendje, a finanszírozási algoritmus
3.1. Az asthma bronchiale diagnosztikájának algoritmusa
Szisztémás antihisztamin-kezelés alatt az allergiás bőrpróba helyett nem végezhető specifikus IgE-meghatározás. A szisztémás antihisztamin-kezelés felfüggesztése után 1 héttel az allergiás bőrpróba elvégezhető.
4. Az asthma bronchiale gyógyszeres kezelésének finanszírozási algoritmusa
4.1. A gyógyszeres kezelés algoritmusában (4. pont) szereplő egyes terápiás lépcsők tartalmát és a vonatkozó feltételeket az alábbiakban részletezzük:
(1) 1. terápiás lépcső.
Rohamoldó szer alkalmazható szükség esetén, amelynek részletes szabályai a (7) pontban szerepelnek.
(2) 2. terápiás lépcső.
a) A választandó kezelés a kis dózisú ICS.
b) LTRA akkor választható az ICS helyett, ha az ICS kontraindikált vagy vele szemben intolerancia lép fel.
(3) 3. terápiás lépcső.
a) A preferált kezelés a kis dózisú ICS+LABA.
b) További választható kezelések:
ba) közepes/nagy dózisú ICS
bb) kis dózisú ICS+LTRA
bc) kis dózisú ICS+teofillin SR
c) Ha az a) és b) pontban meghatározott valamelyik – legalább 3 hónapig tartó – kezelés ellenére az asthma az utolsó 4 hetes időszak vonatkozásában részben kontrollált, ismét választható az a) és b) pontban meghatározott valamelyik kezelés vagy a 4. terápiás lépcsőn folytatható a kezelés.
d) Ha az a) és b) pontban meghatározott valamelyik – legalább 3 hónapig tartó – kezelés ellenére az asthma az utolsó 4 hetes időszak vonatkozásában nem kontrollált, a 4. terápiás lépcsőn folytatható a kezelés.
(4) 4. terápiás lépcső.
a) A preferált kezelés a közepes/nagy dózisú ICS+LABA.
b) További választható kezelések:
ba) kis/közepes/nagy dózisú ICS+LABA+LTRA
bb) kis/közepes/nagy dózisú ICS+LABA+teofillin SR
bc) kis/közepes/nagy dózisú ICS+LABA+LTRA+teofillin SR
bd) közepes/nagy dózisú ICS+LTRA
be) közepes/nagy dózisú ICS+teofillin SR
bf) közepes/nagy dózisú ICS+LTRA+teofillin SR
c) Ha az a) pont szerinti – legalább 3 hónapig tartó – kezelés ellenére az asthma az utolsó 4 hetes időszak vonatkozásában részben kontrollált vagy nem kontrollált, választható a b) pontban meghatározott valamelyik kezelés vagy az 5. terápiás lépcsőn folytatható a kezelés.
d) Ha a b) pont szerinti – legalább 3 hónapig tartó – kezelés ellenére az asthma az utolsó 4 hetes időszak vonatkozásában részben kontrollált, vagy nem kontrollált és az a) pont szerinti kezelést még nem alkalmazták legalább 3 hónapig, választható az a) és b) pontban meghatározott valamelyik kezelés.
e) Ha a b) pont szerinti – legalább 3 hónapig tartó – kezelés ellenére az asthma az utolsó 4 hetes időszak vonatkozásában részben kontrollált, vagy nem kontrollált és az a) pont szerinti kezelést már alkalmazták legalább 3 hónapig, választható a b) pontban meghatározott valamelyik kezelés vagy az 5. terápiás lépcsőn folytatható a kezelés.
(5) 5. terápiás lépcső.
a) A választható kezelések:
aa) a 4. lépcső szerinti kezelés kiegészítése per os szteroiddal
ab) perzisztáló allergiás asthmában a 4. lépcső szerinti kezelés kiegészítése anti-IgE-vel
ac) perzisztáló allergiás asthmában a 4. lépcső szerinti kezelés kiegészítése per os szteroiddal és anti-IgE-vel
ad)perzisztáló súlyos eozinofil asthmában a 4. lépcső szerinti kezelés kiegészítése anti-IL5-tel
ae)perzisztáló súlyos eozinofil asthmában a 4. lépcső szerinti kezelés kiegészítése per os szteroiddal és anti-IL5-tel
b) Az anti-IgE adásának további feltételei:
ba) IgE-szint > 76 NE/ml és az IgE-szint nem haladja meg az alkalmazási előírás szerinti maximális értéket
bb) perenniális inhalatív allergénnel szembeni pozitív bőrpróba vagy specifikus IgE kimutatása a szérumban
bc) szisztémás szteroid tartós alkalmazása ellenére az asthma nem kontrollált vagy nagy dózisú ICS+LABA alkalmazása ellenére gyakoriak a szisztémás szteroidot igénylő exacerbációk (≥ 4/év)
bd) FEV1 < ref. 80%-a
be) az anti-IgE-kezelés megkezdését követően évente értékelni kell a kezelés hatását, és az anti-IgE-kezelés kizárólag akkor folytatható, ha az utolsó egy év során szisztémás szteroidot igénylő exacerbáció legfeljebb 2 alkalommal fordult elő
c) Az anti-IL5 adásának további feltételei:
ca) laboratóriumi vérképvizsgálat által kimutatott perifériás eozinofil sejtszám a terápia megkezdése előtt a készítmény alkalmazási előírásában definiáltnak megfelel, de legalább 300 sejt/µl
cb) szisztémás szteroid kezelés ellenére az asthma nem kontrollált, vagy az elmúlt 12 hónapban legalább 4 szisztémás szteroid kezelést igénylő asthma exacerbáció alakult ki
cc) nagydózisú ICS+LABA fenntartó terápia legalább 6 hónapos rendszeres használata ellenére FEV1<80% és nem kontrollált asthma áll fenn
cd) FEV1 < ref. 80%-a
ce)Az anti-IL5-kezelés megkezdését követően évente értékelni kell a kezelés hatását és az anti-IL5-kezelés kizárólag akkor folytatható, ha az utolsó egy év során szisztémás szteroidot igénylő exacerbáció legfeljebb 2 alkalommal fordult elő
d) Anti-IgE és anti-IL5 egyidejűleg nem alkalmazható.
(6) Újonnan diagnosztizált betegnél meg kell állapítani az asthma kontrollfokát az utolsó 4 hét alapján és a rizikótényezők fennállását vagy hiányát. A gyógyszeres kezelés a kontrollfokhoz és a rizikóbecsléshez igazodó terápiás lépcsőn kezdhető meg.
Új beteg gyógyszeres kezelését az 1. terápiás lépcsőn akkor lehet elkezdeni, ha az utolsó 4 hét vonatkozásában az asthma kontrollált és nincs exacerbációs rizikó.
Új beteg gyógyszeres kezelését a 2. terápiás lépcsőn akkor lehet elkezdeni, ha az utolsó 4 hét vonatkozásában az asthma részben kontrollált, vagy kontrollált és van exacerbációs rizikó.
Új beteg gyógyszeres kezelését a 3. terápiás lépcsőn akkor lehet elkezdeni, ha az utolsó 4 hét vonatkozásában az asthma nem kontrollált, vagy részben kontrollált és van exacerbációs rizikó.
(7) Rohamoldó szerek.
Minden terápiás lépcsőn (1., 2., 3., 4., 5.) használhatók szükség esetén.
a) A választandó kezelés a SABA.
b) Ha a SABA kontraindikált vagy vele szemben intolerancia lép fel, választható a SAMA vagy a SABA+SAMA.
A 3., 4. és 5. terápiás lépcsőn használhatók szükség esetén.
c) ICS és gyors hatáskezdetű LABA (ICS+RABA) fix dózisú kombinációs készítmény. Amennyiben a beteg a 3., 4. vagy 5. terápiás lépcsőn ICS és gyors hatáskezdetű LABA (ICS+RABA) fix dózisú kombinációs készítményt használ fenntartó terápiaként, és e készítmény alkalmazási előírásában a javallatok között szerepel a rohamoldóként történő, szükség szerinti alkalmazás is, úgy e készítmény – az alkalmazási előírásnak megfelelően – használható rohamoldó szerként is.
4.2. Amennyiben az alkalmazott hatóanyagú készítmény kontraindikált, vagy az alkalmazási előírás szerinti dózisban vele szemben intolerancia (tolerálhatatlan mellékhatás) lép fel, azt úgy lehet tekinteni, mintha az érintett hatóanyagcsoporttal a megfelelő dózisban folytatott terápia – a megfelelő eredmény nélkül – megtörtént volna.
4.3. Az inhalációs szteroidok becsült ekvivalens napi adagjai
|
A |
B |
C |
D |
1 |
Hatóanyag |
Alacsony napi dózis
(µg) |
Közepes napi dózis
(µg) |
Magas napi dózis
(µg) |
2 |
beclometason-dipropionát (CFC) |
200-500 |
>500-1000 |
>1000 |
3 |
beclometason-dipropionát (HFA) |
100-200 |
>200-400 |
>400 |
4 |
budesonid (DPI) |
200-400 |
>400-800 |
>800 |
5 |
ciclesonid (HFA) |
80-160 |
>160-320 |
>320 |
6 |
fluticason-propionát (DPI) |
100-250 |
>250-500 |
>500 |
7 |
fluticason-propionát (HFA) |
100-250 |
>250-500 |
>500 |
8 |
fluticason-propionát
(Axahaler) |
50-125 |
>125-250 |
>250 |
9 |
fluticason-furoát * |
100 |
100-200 |
200 |
Az ICS-ot tartalmazó kezelést elrendelő orvos feladata, hogy a dózisekvivalenciát a hatályos szakmai irányelv és az alkalmazási előírás alapján ellenőrizze, az előírt dózist pedig szükség esetén módosítsa.
* Naponta egyszer alkalmazandó, vilanterollal fix kombinációban. |
4.4.
4.4.1. Az asthma kontrollfok osztályozása
|
A |
B |
C |
D |
1 |
Az aktuális klinikai kontroll megállapítása 4 hetes időszak vonatkozásában |
2 |
Jellemző |
Kontrollált
(mindegyik igaz) |
Részben kontrollált (bármelyik jellemző jelenléte esetén) |
Nem kontrollált |
3 |
Nappali tünetek |
nincs (≤ 2x/hét) |
> 2x/hét |
|
4 |
Fizikai aktivitás korlátozottsága |
nincs |
van |
a részben kontrollált asthma legalább három jellemzőjének jelenléte* |
5 |
Éjszakai tünetek, felébredések |
nincs |
van |
|
6 |
Rohamoldó iránti igény |
nincs (≤ 2x/hét) |
> 2x/hét |
|
7 |
Légzésfunkció
(PEF vagy FEV1) ** |
normális |
az elvárt érték vagy az ismert egyéni legjobb érték 80%-a alatt |
|
* Bármilyen exacerbáció esetén a beteg asthmája nem kontrollált, és felül kell vizsgálni a fenntartó kezelés megfelelőségét.
** Bronchodilatátor adása nélkül. |
4.4.2. Az asthma jövőbeli kockázatának felmérése:
a) exacerbáció rizikója
b) instabil asthma
c) légzésfunkció-vesztés
d) gyógyszer-mellékhatások
4.4.3. Az exacerbáció rizikótényezői:
a) Nem kontrollált asthmás tünetek
b) Gyakori SABA használat
c) Elégtelen ICS kezelés, rossz adherencia vagy eszközhasználat
d) Alacsony FEV1 érték (főleg, ha < 60%)
e) Változékony csúcsáramlás
f) Jelentősebb pszichológiai vagy szociális-gazdasági problémák
g) Dohányzás
h) Szenzitizáltság esetén allergén expozíció
i) Társbetegségek: obezitás, rhinosinusitis, táplálékallergia
j) Terhesség
k) Asztma miatti intubáció vagy intenzív osztályos kezelés a kórelőzményben
l) ≥ 1 súlyos exacerbáció az elmúlt 12 hónapban
4.5. Az exacerbáció súlyosság szerinti osztályozásának szempontjai
|
A |
B |
C |
D |
E |
1 |
|
Súlyosság |
|
Klinikai paraméter |
enyhe |
középsúlyos |
súlyos |
fenyegető légzésleállás |
2 |
Nehézlégzés |
nehézlégzés járásra
képes feküdni |
nehézlégzés beszédre
inkább ül |
nehézlégzés nyugalomban
előrehajol |
|
3 |
Beszéd |
mondatok |
frázisok |
szavak |
|
4 |
Éberség |
izgatott lehet |
általában izgatott |
általában izgatott |
aluszékony vagy zavart |
5 |
Légzési frekvencia |
emelkedett |
emelkedett |
gyakran > 30/perc |
|
6 |
Légzési segédizmok és suprasternális behúzódás |
általában nem |
általában igen |
általában igen |
paradox thoraco-abdominális mozgás |
7 |
Sípolás |
mérsékelt, gyakran csak a kilégzés végén |
hangos |
általában hangos |
sípolás hiánya |
8 |
Pulzus/perc |
< 100 |
100-120 |
> 120 |
bradycardia |
9 |
Pulzus paradoxus |
nincs
< 10 Hgmm |
jelen lehet
10-25 Hgmm |
gyakran
> 25 Hgmm |
hiánya jelzi a légzőizmok kifáradását |
10 |
Hörgtágító utáni PEF a kívánt vagy az egyéni legjobb érték %-ában |
> 80% |
60-80% |
< 60%
(< 100 l/min)
vagy
a válasz tartama
< 2 h |
|
11 |
PaO2 |
normális, általában nem kell vizsgálni |
> = 60 Hgmm |
< 60 Hgmm cyanosis lehetséges |
|
12 |
PaCO2 |
< 45 Hgmm |
< 45 Hgmm |
>= 45 Hgmm légzési elégtelenség lehetséges |
|
13 |
SaO2 |
> 95% |
91-95% |
< = 90% |
|
5. Az asthma bronchiale akut exacerbációja diagnosztikájának és gyógyszeres kezelésének algoritmusa
6. Az asthma bronchiale gyógyszeres kezelése kontrollfokhoz történő igazításának algoritmusa
A gyógyszeres kezelés kontrollfokhoz történő igazításának algoritmusában szereplő döntések tartalmát és a vonatkozó feltételeket az alábbiakban részletezzük:
(1) Minden betegnek 6 havonta legalább egyszer részt kell vennie szakorvosi kontrollvizsgálaton.
(2) Ha a legalább 3 hónapja alkalmazott gyógyszeres kezeléssel az asthma legalább 3 hónapja kontrollált, a kezelőorvos döntése alapján meg lehet kísérelni a gyógyszerelés csökkentését.
Ha az asthma legalább 6 hónapja kontrollált és nincs exacerbációs rizikótényező, meg kell kísérelni a gyógyszerelés csökkentését.
A gyógyszerelés csökkenthető a dózis csökkentésével vagy egy gyógyszer elhagyásával. Ennek megfelelően a terápia folytatható az azonos vagy az eggyel alacsonyabb lépcsőn.
A 2. lépcsőn a fenntartó gyógyszerelés akkor hagyható el teljesen, ha az asthma legalább 1 éve kontrollált.
(3) Ha az 1. vagy a 2. lépcső szerinti, legalább 3 hónapja alkalmazott gyógyszeres kezelés ellenére az asthma az utolsó 4 hetes időszak vonatkozásában nem kontrollált vagy részben kontrollált, az eggyel magasabb lépcsőn folytatható a kezelés.
(4) Ha a 3. lépcső szerinti, legalább 3 hónapja alkalmazott gyógyszeres kezelés ellenére az asthma az utolsó 4 hetes időszak vonatkozásában nem kontrollált, a 4. lépcsőn folytatható a kezelés. Ha az asthma az utolsó 4 hetes időszak vonatkozásában részben kontrollált, a kezelőorvos döntése szerint vagy a 4. lépcsőn vagy a 3. lépcső eddig nem alkalmazott terápiájával folytatható a kezelés.
(5) Ha a 4. lépcső szerinti, legalább 3 hónapig alkalmazott gyógyszeres kezelés ellenére az asthma az utolsó 4 hetes időszak vonatkozásában nem kontrollált vagy részben kontrollált, és a preferált kezelést (közepes/nagy dózisú ICS+LABA) már alkalmazták legalább 3 hónapig, a kezelőorvos döntése szerint vagy az 5. lépcsőn vagy a 4. lépcső eddig nem alkalmazott terápiájával folytatható a kezelés. Ha a 4. terápiás lépcsőn a preferált kezelést még nem alkalmazták legalább 3 hónapig, a 4. lépcső eddig nem alkalmazott terápiájával folytatható a kezelés.
(6) Akut exacerbáció fellépése esetén annak ellátására külön szabályok vonatkoznak (az 5. pont szerinti ábra és a 4.5. pont szerinti táblázat).
(7) Akut exacerbáció kezelését és lezajlását követően felül kell vizsgálni a fenntartó gyógyszeres kezelést. E felülvizsgálat során meg kell állapítani az exacerbációt közvetlenül megelőző, az exacerbációtól még mentes 4 hetes időszakra vonatkozó kontrollfokot. Ha a megelőző 4 hét során az asthma kontrollált volt, az exacerbációt követően a korábbi fenntartó gyógyszeres kezelés folytatandó. Ha a megelőző 4 hét során az asthma nem kontrollált vagy részben kontrollált volt, az exacerbációt követően a (3), (4), (5) pont szerint fokozható a gyógyszeres kezelés.
7. A finanszírozási szakmai ellenőrzés alapját képező ellenőrzési sarokpontok
A finanszírozási ellenőrzés során elsősorban azt szükséges vizsgálni, hogy a kezelőorvosok betartották-e a kihirdetett finanszírozási eljárásrend szerinti terápiás lépcsőket. A legfontosabb ellenőrzési sarokpontok a következők:
7.1. Az asthma bronchiale diagnózisának felállítása az előírt módon történt-e (különös tekintettel a légzésfunkciós vizsgálatra, az allergiás bőrpróba és a specifikus IgE-meghatározás feltételeire)?
7.2. A beteg a kórelőzmény és a kontrollfok alapján szükséges terápiás lépcső szerinti gyógyszeres kezelést kapja-e?
7.3. Terápiás lépcső váltása, valamint terápia lépcsőn belüli váltása esetén valóban nem volt-e elérhető a kontroll az adekvát terápia megfelelő alkalmazásával?
7.4. A kontroll elérése és fennállása esetén történt-e érdemi próbálkozás a gyógyszerelés csökkentésére?
8. A finanszírozási eljárásrend alkalmazásának hatását mérő minőségi indikátorok
8.1. azon betegek arányának alakulása, akiknél a finanszírozási eljárásrend szerinti diagnosztikus és terápiás utak a kapcsolódó kritériumokkal együtt maradéktalanul megvalósulnak,
8.2. az asthma bronchiale ellátására fordított finanszírozási összegek ellátási formák szerinti alakulása,
8.3. az asthma bronchiale gyógyszeres kezelésére fordított ártámogatási összegek gyógyszercsoportok szerinti alakulása.
9. A finanszírozás szempontjából lényeges finanszírozási kódok
9.1. Releváns BNO kódok
|
A |
B |
1 |
BNO |
BNO megnevezése |
2 |
J45 |
Asthma bronchiale |
3 |
J46H0 |
Status asthmaticus |
9.2. Releváns OENO kódok
|
A |
B |
1 |
OENO |
OENO megnevezése |
2 |
17021 |
Intracutan allergia próba, azonnali reakció |
3 |
17071 |
Légúti aspecifikus bronchiális provokáció |
4 |
17072 |
Légúti allergia provokáció, specifikus antigénnel |
5 |
17073 |
Fizikai terhelés hatásának vizsgálata a hörgőkre |
6 |
17102 |
Spirometria |
7 |
17191 |
Dohányzás leszokás támogatás – paciens vizsgálat |
8 |
17192 |
Dohányzás leszokás támogatás – leszokási vizit |
9 |
17193 |
Dohányzás leszokás támogatás – kilégzett levegő szénmonoxid mértékének a meghatározása |
10 |
17194 |
Csoportos dohányzás leszokás támogatása |
11 |
21202 |
Vérgáz analízis |
12 |
2678E |
Allergén specifikus IgE meghatározása |
13 |
31310 |
Mellkasfelvétel, AP/PA |
14 |
31311 |
Mellkasfelvétel, oldalirányú |
15 |
31312 |
Mellkasfelvétel, kétirányú |
16 |
31380 |
Mellkasfelvétel, célzott |
17 |
3521A |
Perfúziós tüdőszcintigráfia |
18 |
3521B |
Inhalációs tüdőszcintigráfia Tc-mal jelzett farmakonnal |
19 |
40060 |
Mellkas-szűrővizsgálat |
20 |
87510 |
Inhalációs terápia gyógyszerrel vagy gyógynövénnyel |
21 |
87600 |
Oxigén terápia |
22 |
89442 |
Pulzoxymetria |
9.3. Releváns HBCS kódok
|
A |
B |
1 |
HBCS |
HBCS megnevezése |
2 |
04M 1320 |
Légzőrendszeri betegségek légzéstámogatással |
3 |
04M 1430 |
Asthma, bronchitis, egyéb krónikus obstruktív betegségek 18 év felett, speciális kezeléssel |
4 |
04S 144C |
Status asthmaticus és egyéb légúti betegségek sürgősségi ellátása |
5 |
04M 174Z |
Légzőrendszeri fertőzések, gyulladások, súlyos társult betegséggel |
6 |
04M 175Z |
Légzőrendszeri betegségek, egyéb fertőzések (kivéve: gümőkór polirezisztens kórokozóval) súlyos társult betegséggel |
9.4. Releváns ATC kódok
|
A |
B |
1 |
ATC |
ATC megnevezése |
2 |
H02AB04 |
Metilprednizolon |
3 |
H02AB06 |
Prednizolon |
4 |
R03AC02 |
Salbutamol |
5 |
R03AC12 |
Salmeterol |
6 |
R03AC13 |
Formoterol |
7 |
R03AK06 |
Salmeterol és fluticasone |
8 |
R03AK07 |
Formoterol és budesonide |
9 |
R03AK08 |
Formoterol és beclometasone |
10 |
R03AK10 |
Vilanterol és fluticasone-furoate |
11 |
R03AK12 |
Salmeterol és budesonide |
12 |
R03AL01 |
Fenoterol és ipratropium-bromide |
13 |
R03BA02 |
Budesonide |
14 |
R03BA05 |
Fluticasone |
15 |
R03BA08 |
Ciclesonid |
16 |
R03BB01 |
Ipratropium-bromide |
17 |
R03DA04 |
Teofillin |
18 |
R03DC03 |
Montelukast |
19 |
R03DX05 |
Omalizumab |
20 |
R03DX08 |
Reslizumab |
21 |
R03DX09 |
Mepolizumab |
9.5. Releváns ISO kódok
|
A |
B |
1 |
ISO |
ISO megnevezése |
2 |
04 03 06 03 03 |
Ultrahangos inhalátorok |
3 |
04 03 06 06 03 |
Kompresszoros inhalátorok |
4 |
04 03 27 03 03 |
Beszívási, illetve kifújási ellenállást képező maszkok |
5 |
04 03 30 |
Légzésmérők |
6 |
04 03 33 |
Egyéb légzésgyógyászati eszközök |
10. Fogalmak, rövidítések
GINA: |
Global Initiative for Asthma |
NEAK: |
Nemzeti Egészségbiztosítási Alapkezelő |
TB: |
Társadalombiztosítás |
HBCS: |
Homogén betegségcsoport |
OENO: |
Orvosi Eljárások Nemzetközi Osztályozása |
BNO: |
Betegségek Nemzetközi Osztályozása |
ATC: |
Anatomical, therapeutic, chemical klasszifikáció |
DOT: |
Day of therapy (terápiás napok) |
NTK: |
Napi terápiás költség |
FEV: |
Forced exspiratory volume (erőltetett kilégzési térfogat) |
FEV1: |
Forced exspiratory volume in one second (erőltetett kilégzési térfogat 1 másodperc alatt) |
FVC: |
Forced vital capacity (erőltetett vitálkapacitás) |
PEF: |
Peak exspiratory flow (kilégzési csúcsáramlás) |
IC: |
Inspiratory capacity (belégzési kapacitás) |
IVC: |
Inspiratory vital capacity (belégzési vitálkapacitás) |
EVC: |
Exspiratory vital capacity (kilégzési vitálkapacitás) |
BHR: |
Bronchiális hiperreaktivitás |
SABA: |
Short-acting β2-agonist (rövid hatású β2-agonista) |
LABA: |
Long-acting β2-agonist (hosszú hatású β2-agonista) |
RABA: |
Rapid-acting β2-agonist (gyors hatású β2-agonista) |
SAMA: |
Short-acting muscarinic antagonist (rövid hatású muszkarinerg-antagonista) |
LAMA: |
Long-acting muscarinic antagonist (hosszú hatású muszkarinerg-antagonista) |
ICS: |
Inhaled corticosteroid (inhalációs kortikoszteroid) |
SCS: |
Szisztémás kortikoszteroid |
LTRA: |
Leukotrién-receptor-antagonista |
Teofillin SR: |
Hosszú hatású teofillin |
Anti-IgE |
Anti-immunglobulin-E |
Anti-IL5 |
Anti-interleukin-5 |
NIV: |
Nem invazív gépi lélegeztetés |
MDI: |
Metered dose inhaler (adagolószelepes aeroszol) |
DPI: |
Dry powder inhaler (szárazpor-inhalátor) |
GYSE: |
Gyógyászati segédeszköz” |
”
18. melléklet a 35/2018. (X. 12.) EMMI rendelethez
„3. STEMI finanszírozási algoritmusa
”
„4.9. PCI után 12 hónapig ASA és clopidogrel terápia folytatása szükséges. (9)
ASA+prasugrel kombinációt kaphatnak eü. emelt támogatással 12 hónapig azok a betegek, akiknél percutan coronaria intervenció és stent beültetés történt, emellett kórelőzményükben stroke vagy transiens ischaemiás attack (TIA) nem szerepel és clopidogrel allergia vagy laboratóriumilag igazolt non-reszponzió vagy igazolt diabetes mellitus áll fenn vagy stent trombózist szenvedtek el.
ASA+ticagrelor kombinációt kaphatnak eü. emelt támogatással 12 hónapig azok a betegek, akiknél percutan coronaria intervenció és stent beültetés történt, és clopidogrel allergia vagy laboratóriumilag igazolt non-reszponzió vagy igazolt diabetes mellitus áll fenn vagy stent trombózist szenvedtek el, valamint azok a betegek, akik krónikus veseelégtelenségben szenvednek (kreatinin clearance < 60ml/perc)”
„5.2.2. A kórkép korai kezelésének megkezdése és dokumentálásának ellenőrzése
5.2.2.1. ASA+ clopidogrel
5.2.2.2. ASA+ ticagrelor
5.2.2.3. ASA+ prasugrel
5.2.2.4. sztatin kezelés
5.2.2.5. béta-blokkoló, amennyiben nem kontraindikált
5.2.2.6. ACE-gátló, illetve ACE-gátló intolerancia vagy mellékhatás esetén ARB (csökkent balkamra funkció esetén)”
„6.5. A releváns ATC kódok
|
A |
B |
1 |
ATC |
ATC megnevezés |
2 |
B01AC06 |
acetilszalicilsav |
3 |
B01AC04 |
clopidogrel |
5 |
B01AC22 |
prasugrel |
4 |
B01AC24 |
ticagrelor |
6 |
B01AD01 |
streptokinase |
7 |
B01AD02 |
alteplase |
8 |
B01AD11 |
tenecteplase |
9 |
C10AA01 |
simvastatin |
10 |
C10AA05 |
atorvastatin |
11 |
C10AA07 |
rosuvastatin |
12 |
C10AX09 |
ezetimibe |
13 |
C10BA02 |
ezetimibe-simvastatin |
14 |
C09A |
ACE-inhibitorok önmagukban |
15 |
C09B |
ACE-inhibitorok kombinációban |
16 |
C09CA |
angiotensin II antagonisták önmagukban |
17 |
C09D |
angiotensin II antagonisták kombinációi |
18 |
C07AB02 |
metoprolol |
19 |
C07AB07 |
bisoprolol |
20 |
C07AB12 |
nebivolol |
21 |
C07AG02 |
carvedilol |
22 |
C07BB07 |
bisoprolol+thiazidok |
23 |
C07FB02 |
metoprolol+egyéb vérnyomáscsökkentők |
”
19. melléklet a 35/2018. (X. 12.) EMMI rendelethez
„3.3. A nem-kissejtes tüdődaganat ellátása EGFR-TK aktiváló mutáció negatív betegeknél
 ”
”„3.5. Megjegyzés:
A pemetrexed, bevacizumab, gefitinib, erlotinib, afatinib, nintedanib, pembrolizumab, nivolumab, atezolizumab, alectinib, crizotinib tételes elszámolás alá eső hatóanyagok, a támogatott indikációk az alábbiak:
3.5.1. Pemetrexed: Lokálisan előrehaladott vagy metasztatikus adenocarcinoma és nagysejtes carcinoma típusú, nem-kissejtes tüdőrák elsővonalbeli kezelése platina-alapú kombinációban. Lokálisan előrehaladott vagy metasztatikus nem laphámsejtes, nem-kissejtes tüdőrák másodvonalbeli kezelése monoterápiában.
3.5.2. Bevacizumab: Inoperábilis előrehaladott, metasztatikus vagy kiújuló tüdő adenocarcinoma elsővonalbeli kezelése platina-alapú kemoterápiával kombinációban, majd azt követően monoterápiában progresszióig.
3.5.3. Gefitinib: Lokálisan előrehaladott vagy metasztatikus, nem-kissejtes tüdő adenocarcinómában szenvedő felnőtt betegek kezelésére, akiknél fennáll EGFR-TK aktiváló mutáció.
3.5.4. Erlotinib: Lokálisan előrehaladott vagy metasztatikus, nem-kissejtes tüdő adenocarcinómában szenvedő felnőtt betegek kezelésére, akiknél fennáll EGFR-TK aktiváló mutáció. Lokálisan előrehaladott vagy metasztatikus, nem-kissejtes tüdőkarcinómában szenvedő felnőtt betegek másod- és többedvonalbeli kezelésére, akiknél legalább egyféle kemoterápiás kezelés ellenére a WHO-kritériumok szerint értékelt progresszió jelentkezik, és az EGFR-TK (epidermális növekedési faktor receptor tirozinkináz) aktiváló mutációja vagy a K-RAS mutációjának hiánya (vad típus) igazolt, legfeljebb a WHO-kritériumok szerinti további progresszióig.
3.5.5. Afatinib: Lokálisan előrehaladott vagy metasztatikus, nem-kissejtes tüdő adenocarcinómában szenvedő felnőtt betegek kezelésére, akiknél fennáll EGFR-TK aktiváló mutáció.
3.5.6. Nintedanib: Lokálisan előrehaladott, metasztatikus vagy lokálisan kiújult nem kissejtes tüdő adenocarcinómában szenvedő felnőtt betegek kezelésére docetaxellel kombinációban, első vonalbeli kemoterápia után.
3.5.7. Pembrolizumab: Lokálisan előrehaladott vagy metasztatikus, nem kissejtes tüdő adenocarcinomában szenvedő, jó általános állapotú (ECOG 0-1), KRAS mutáns, vagy EGFR és ALK pozitivitást nem mutató felnőtt betegek első-, másod- vagy harmadvonalban történő kezelésére, akiknél a daganat esetében igazoltan erős PD-L1 expresszió mutatható ki (TPS≥50%). Laphámsejtes carcinoma esetén első- és másodvonalban alkalmazható igazoltan erős PD-L1expresszió esetén (TPS≥50%). A fenti indikációkban történő alkalmazás feltétele az, hogy a beteg korábban nem kapott immunterápiát.
3.5.8. Nivolumab: Lokálisan előrehaladott vagy metasztatikus, nem kissejtes tüdő adenocarcinomában szenvedő, jó általános állapotú (ECOG 0-1), KRAS mutáns, vagy EGFR és ALK pozitivitást nem mutató felnőtt betegek másod vagy harmadvonalban történő kezelésére monoterápiában. Laphámsejtes carcinoma esetén csak másodvonalban alkalmazható. A fenti indikációkban történő alkalmazás feltétele az, hogy a beteg korábban nem kapott immunterápiát.
3.5.9. Atezolizumab: Lokálisan előrehaladott vagy metasztatikus, nem kissejtes tüdő adenocarcinomában szenvedő, jó általános állapotú (ECOG 0-1), KRAS mutáns, vagy EGFR és ALK pozitivitást nem mutató felnőtt betegek másod vagy harmadvonalban történő kezelésére monoterápiában. Laphámsejtes carcinoma esetén csak másodvonalban alkalmazható. A fenti indikációkban történő alkalmazás feltétele az, hogy a beteg korábban nem kapott immunterápiát.
3.5.10. Alectinib: Anaplasticus lymphoma-kináz (ALK)-pozitív, előrehaladott, nem kissejtes tüdőcarcinoma első- és másodvonalbeli kezelésére felnőtt betegeknél.
3.5.11. Crizotinib: Anaplasticus lymphoma-kináz (ALK)-pozitív, előrehaladott, nem kissejtes tüdőcarcinoma elsővonalbeli kezelésére felnőtt betegeknél, amennyiben az egyedi betegprofil ezt indokolja. Anaplasticus lymphoma-kináz (ALK)-pozitív, előrehaladott, nem kissejtes tüdőcarcinoma másodvonalbeli kezelésére felnőtt betegeknél, kivéve, ha korábban ALK gátló kezelésben részesült.”
„4. A nem-kissejtes tüdődaganat finanszírozásának ellenőrzési kritériumai
4.1. Adminisztratív ellenőrzési pontok (folyamatba épített ellenőrzés)
4.1.1. Kompetencia szint: kijelölt intézmény, szakorvosi kompetencia ellenőrzése
4.1.2. Betegadatok (online TAJ ellenőrzés)
4.1.3. Jogszabályban rögzített indikációs terület BNO ellenőrzése
4.2. Szakmai ellenőrzési pontok
4.2.1. Stádiumbeosztásra vonatkozó adatok megtalálhatóak-e?
4.2.2. A relapszus/progesszió igazolt és megfelelően dokumentált?
4.2.3. Megfelelően igazolták-e az EGFR-TKés az ALK mutációt?
4.2.4. Igazolódott-e pembrolizumab alkalmazása esetén a TPS≥50% PDL-1 expresszió?”
„6.4. Releváns ATC kódok
|
A |
B |
1 |
ATC kód |
ATC megnevezés |
2 |
L01XA02 |
carboplatin |
3 |
L01XA01 |
cisplatin |
4 |
L01AA01 |
cyclophosphamid |
5 |
L01CD02 |
docetaxel |
6 |
L01CB01 |
etoposide |
7 |
L01BC05 |
gemcitabine |
8 |
L01AA06 |
ifosfamide |
9 |
V03AF01 |
mesna |
10 |
L01CD01 |
paclitaxel |
11 |
L01BA04 |
pemetrexed |
12 |
L01CA04 |
vinorelbine |
13 |
L01XC07 |
bevacizumab |
14 |
L01XC17 |
nivolumab |
15 |
L01XC18 |
pembrolizumab |
16 |
L01XC |
atezolizumab |
17 |
L01XE02 |
gefitinib |
18 |
L01XE03 |
erlotinib |
19 |
L01XE13 |
afatinib |
20 |
L01XE31 |
nintedanib |
21 |
L01XE16 |
crizotinib |
22 |
L01XE36 |
alectinib |
”
„7. Rövidítések
ALK |
Anaplasticus-lymphoma kináz |
CR |
Komplett remisszió |
CT |
Computer tomográfia |
EBUS |
Endobronchialis ultrasound (endobronchiális ultrahang) |
EGFR |
Epidermális növekedési faktor |
EGFR-TK |
Epidermális növekedési faktor receptor tirozinkináz |
KRAS |
Daganat növekedését befolyásoló gén |
NSCLC |
Non small cell lung cancer (Nem-kissejtes tüdődaganat) |
MR |
Mágneses rezonancia vizsgálat |
PET-CT |
Pozitron emissziós tomográfia |
PR |
Parciális remisszió |
PS |
Általános állapot |
rtg |
Röntgen |
SD |
Változatlan állapot (stable disease) |
TBNA |
Transbronchialis needle biopsy (transbronchialis tűbiopszia) |
TPS |
Tumor Proportion Score – PD-L1-et expresszáló tumorsejt arány |
UH |
Ultrahang |
WBRT |
Whole brain radiotherapy (teljes agykoponya besugárzás) |
”
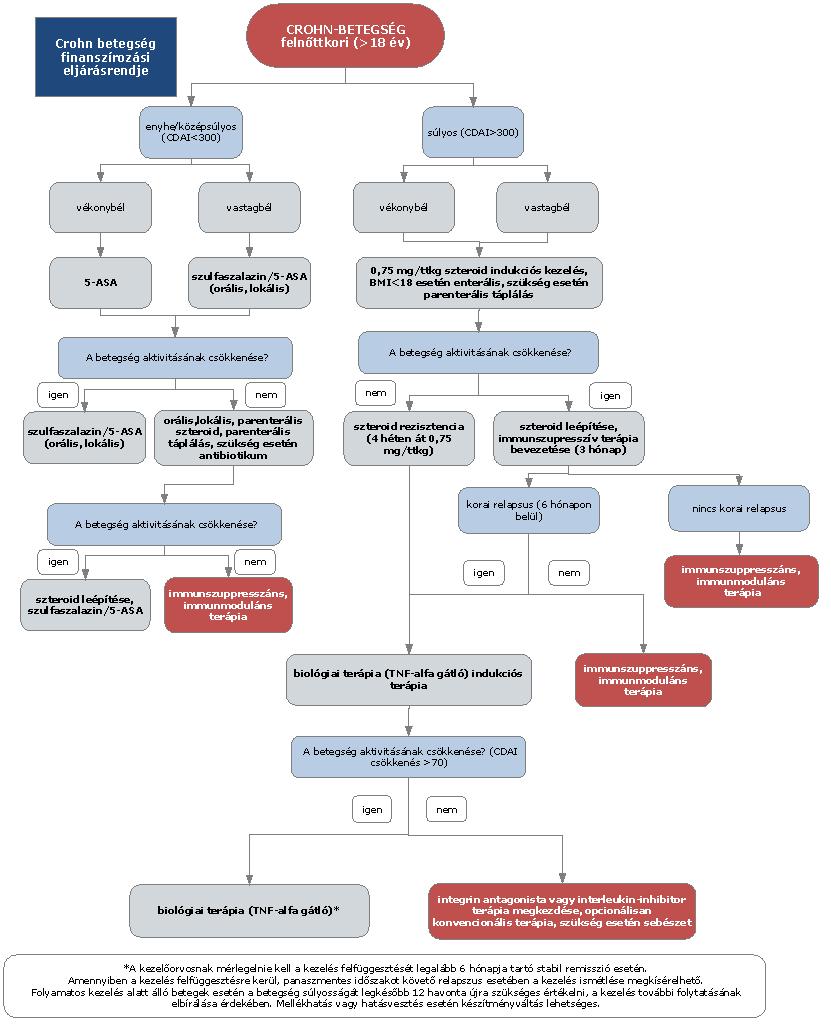
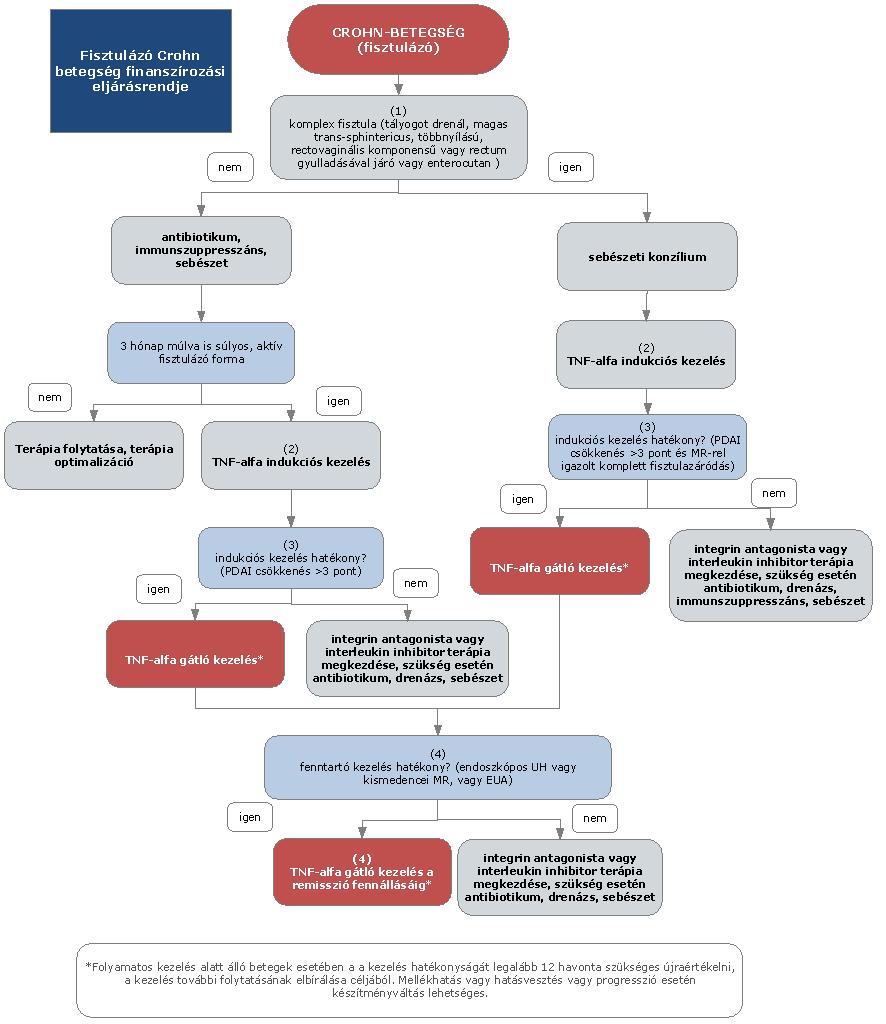
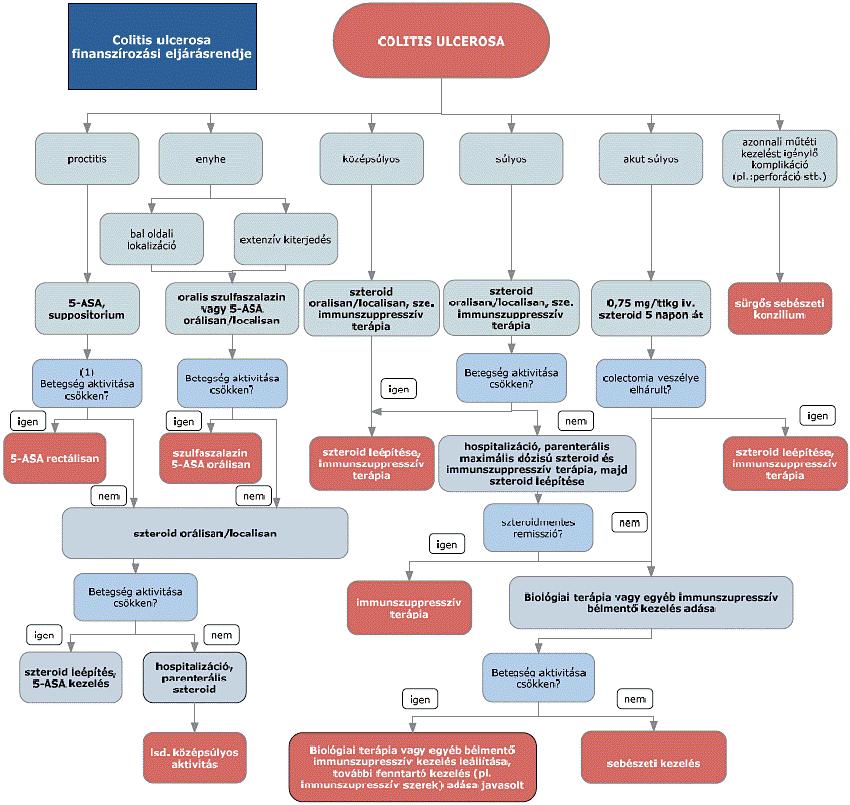
 ”
” ”
”
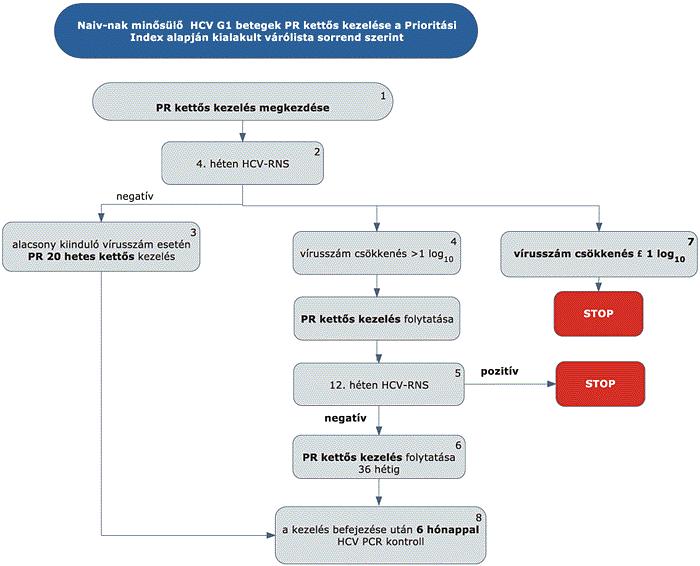
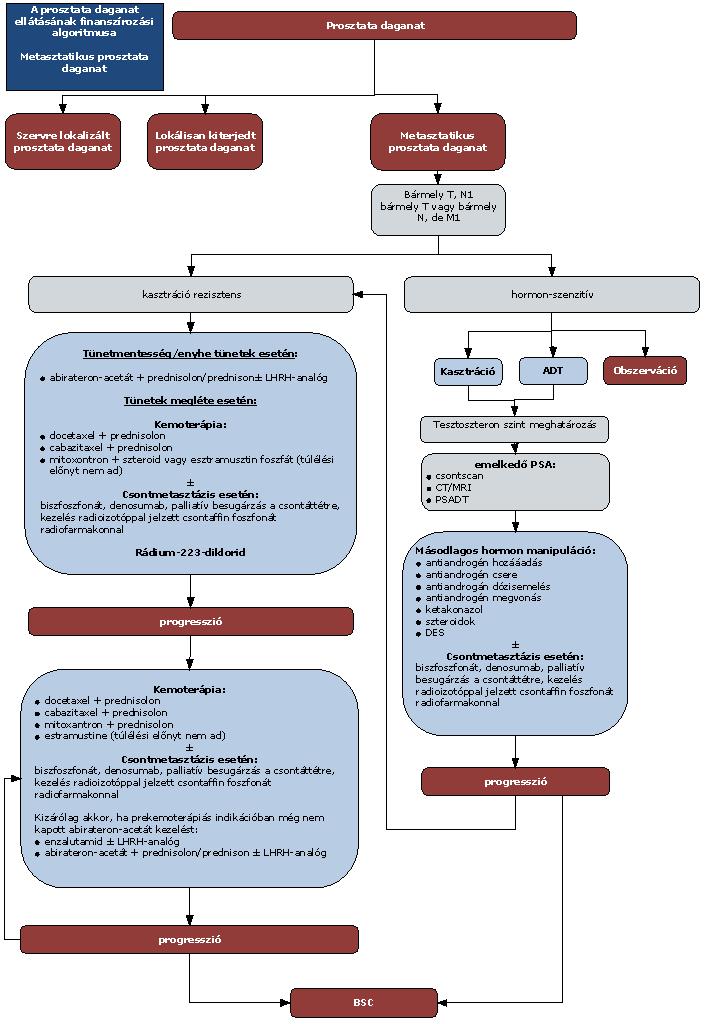
 „
„
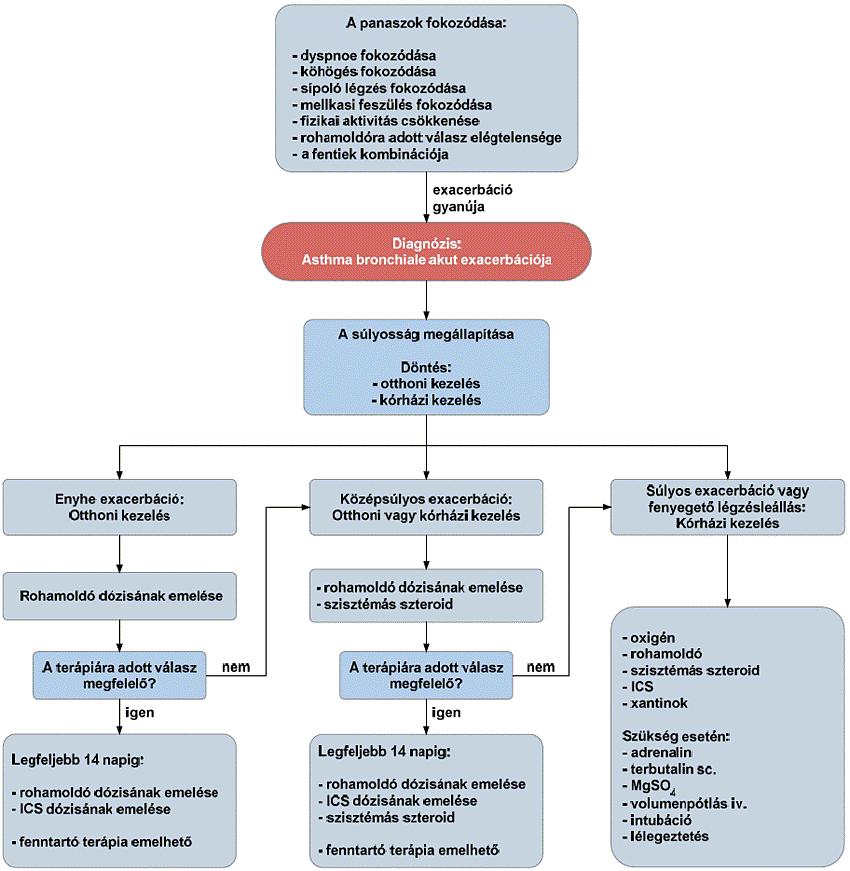
 ”
”


